|
|
|
INTRODUZIONE
Viviamo nell’era
dell’evidence-based medicine. Ogni nuova acquisizione, che si tratti di
un concetto o di una tecnica da impiegare clinicamente, dovrebbe
trovare conferma in studi clinici randomizzati. Questo, tuttavia, pone
un problema considerevole nelle ricerca in Endodonzia. L'esito
favorevole, cioè il successo, del trattamento è definito come la
riduzione di una lesione radiografica con assenza di sintomi clinici a
carico del dente interessato dopo un periodo minimo di osservazione di
1 anno (Ørstavik 1996). In alternativa possono essre definite alcune
cosiddette variabili sostitutive del successo, che forniscono risultati
più rapidi, come ad esempio la carica microbica residua che rimane nel
sistema canalare dopo diversi protocolli di trattamento. Tuttavia esse
non sono necessariamente correlate con il “vero” esito del trattamento
(Peters et al. 2002). Il successo di un trattamento endodontico
dipende da molti fattori (Ørstavik et al. 2004), e
l'inefficacia di un passaggio della terapia può venire compensata e
mascherata. Ad esempio, se dopo disinfezione inadeguata rimangono nel
canale microrganismi patogeni, essi teoricamente possono essere
incarcerati nel canale da un’otturazione perfetta dello stesso (Salehet
al. 2004), e il successo clinico essere acquisito comunque (Peters et
al. 2002). D’altro canto, in uno studio clinico metodologicamente
corretto, i singoli passaggi del trattamento devono essere randomizzati
e messi in relazione all’esito. Altrimenti i risultati non legittimano
alcuna conclusione, e non può essere rilevata alcuna relazione causale
(Alderson et al. 2004.).
Il problema è che non esistono studi clinici controllati e randomizzati
in letteratura endodontica circa l’effetto delle soluzioni irraganti
sull’esito del trattamento. Noi dipendiamo largamente da dati ricavati
da studi in vitro e da studi clinici che valutano come esito
sostitutivo la riduzione della carica batterica dopo trattamento.
Indicazioni cliniche basate su risultati di questo tipo sono semplici
deduzioni, e devono essere interpretate con cautela. Ciò nonostante, in
questi lavori possono valutare problemi selezionati, e si possono
ottenere utili informazioni di base.
La patologia pulpare può essere la conseguenza di un insulto
traumatico, o dell’azione di agenti chimici, così come di stimoli
termici eccessivi. Va anche considerata la possibilità di un
coinvolgimento in corso di patologia parodontale. Ma nella maggior
parte dei casi la patologia pulpare deriva da carie.
Non c’è oggi alcun dubbio sul
fatto che i microrganismi, perché sono rimasti nello spazio canalare al
termine del trattamento o perché sono stati in grado di ricolonizzarlo
dopo l’otturazione, sono la principale causa di fallimento endodontico
(Sjögren et al. 1997, Molander et al. 1998). Schilder (1974) dichiarava:
"i canali radicolari devono essere ripuliti e sagomati: ripuliti dai
residui organici, e sagomati perché possano essere otturati
tridimensionalmente nell'intero spazio canalare". E’ stata da alcuni
considerata più importante la fase di detersione e sagomatura rispetto
alla fase di otturazione del canale (Heuer 1963,
Weine et al. 1975, Martin et al. 1980, Reynolds et
al. 1987). Questi due momenti sono, comunque, finalizzati ad
ostacolare l'infiltrazione, la crescita e l'azione dei batteri, e sono
strettamente interconnessi: con una detersione e una sagomatura
accurate si creano le condizioni perché possa essere otturato il
sistema canalare. Non essendo possibile né ottenere, né mantenere una
condizione di sterilità del sistema canalare, ed essendo d’altra parte
il sigillo completo dello stesso solo un obiettivo ideale e non
realizzabile in termini assoluti, quanto di potenzialmente nocivo
residua dopo la preparazione può venire neutralizzato dalla fase di
otturazione, così come parcellari difetti di riempimento possono non
produrre conseguenze grazie alla preliminare detersione e
decontaminazione dei canali.
La detersione è il risultato dell'azione meccanica degli strumenti
sulle pareti del canale, così come del flusso e dell'azione chimica
degli irriganti. Ottenere una detersione completa è impossibile per le
complessità anatomiche che caratterizzano il sistema, come ad esempio
istmi, nicchie ed anfrattuosità, che impediscono la completa rimozione
dei detriti e dei batteri all'interno dei canali radicolari (Bystrom
& Sundqvist 1981, Bystrom & Sundqvist 1983, Bystrom &
Sundqvist 1985, Siqueira et. al. 2002).
|
|
|
|
Sulla radiografia la
complessità del sistema canalare è solo in parte riconoscibile
|
Gli studi in letteratura sono
concordi sul fatto che la detersione canalare non è mai completa (Gutierrez & Garcia
1968, Haga 1968) e che con altissima frequenza nei canali al
termine del trattamento endodontico sono presenti residui organici ed
inorganici.
Anche se i risultati in letteratura sono per la verità assai difficili
da interpretare e spesso assai controversi su molti aspetti.
Basti pensare che con la sola
strumentazione meccanica, e quindi senza impiego di irriganti, sono
state ottenute colture negative alla fine del primo appuntamento nel
20-30 % dei casi da Ingle & Zeldow (1958), da Grahnén & Krasse
(1963), da Stewart et al.
(1969) e da Weine et al. (1973).
E tuttavia, è stato dimostrato
che il riscontro di coltura negativa dopo sagomatura e irrigazione
protratta è solo transitorio (Ingle et al. 1958, Shih et al.
1970).
|
Ingle & Zeldow (1958)
all'appuntamento successivo trovarono confermata la coltura
negativa, ottenuta con preparazione e irrigazione del canale
nella seduta precedente, solo nel 5% dei casi. Grahnen & Krasse
(1963) nel 48% dei casi, Bence et al. (1973) nel 46,7% dei
casi.
|
In realtà, anche il valore
dell'esame colturale dei canali a fine preparazione è assai discusso.
|
Seltzer et al.
(1963) affermarono che l'esame colturale non era ne' accurato,
ne' utile come mezzo per valutare la sterilità dei canali.aGrossman (1970) al contrario
dichiarò che l'esame colturale era il miglior sistema per valutare la
sterilità dei canali radicolari. Morse (1971) di nuovo negò
l'attendibilità dell'esame colturale.
Bence et al. (1973)
effettuarono colture da prelievi in dentina, che risultarono
inizialmente tutte positive, dopo strumentazione meccanica negative nel
21,4% dei casi, dopo irrigazione con NaOCl negative nel 75% dei casi
(il 53,3% dei quali dava reperto positivo in seduta succesiva);
dichiararono che la positività della coltura da prelievi in dentina
dimostrava la penetrazione batterica dei tubuli; sottolinearono
che le colture da prelievo con cono di carta si rivelavano piu
frequentemente positive che quelle da prelievo di dentina.
Byström &
Sundqvist (1983), dopo 5 sedute di irrigazione con NaOCl allo 0.5% e
altrettante di irrigazione con soluzione salina, ottennero colture
negative rispettivamente in 12 casi su 15 e in
8 casi su 15
|
Ad ogni
buon conto, un sistema canalare il più possibile deterso e
decontaminato è il risultato di un'azione chimica e meccanica di
dissolvimento della sostanza organica e dei detriti inorganici, di una
rimozione di entrambe le componenti, e di un effetto antibatterico. Gli
irriganti a questo proposito hanno un ruolo fondamentale.
SISTEMA CANALARE E BATTERI
In funzione del trattamento, dovrebbero essere differenziati gli
elementi vitali da quelli non vitali (Zehnder et al. 2002). La
pulpite è la reazione dell’ospite a patogeni opportunisti che dal cavo
orale penetrano nel sistema canalare (Hahn et al. 2000). La
polpa viva può difendersi dai microrganismi, ed è quindi in larga
misura non infetta fino a quando non diviene necrotica (Langeland
1987). Viceversa, lo spazio pulpare di denti necrotici con segni di
radiotrasparenza periapicale contiene sempre microrganismi ( Sundqvist
1976.). Conseguentemente, il trattamento endodontico di elementi a
polpa viva dovrebbe mirare all’asepsi, ovvero alla prevenzione
dell’ingresso di agenti infettivi in un ambiente inizialmente sterile
come il terzo apicale del canale radicolare. L’antisepsi, ovvero il
tentativo di rimuovere tutti i microrganismi già presenti, dovrebbe
essere l’obiettivo del trattamento dei canali necrotici. Va
sottolineato che la vitalità della polpa non sempre può essere
determinata con tests diagnostici prima del trattamento (Seltzer et
al. 1963). Una volta effettuata la cavità d’accesso, tuttavia, il
clinico può distinguere chiaramente se si trova di fronte a tessuto
vitale o non vitale (Petersson et al. 1999), e può scegliere
il trattamento appropriato.
Asepsi significa innanzitutto isolamento con diga di gomma e
disinfezione della corona dell’elemento (Walker 1936). A causa della
complessa anatomia dei sistemi canalari, l’antisepsi è più difficile da
attuare, sia dal punto di vista tecnico che microbiologico, nei canali
necrotici e nei canali già trattati con esito negativo che nei canali a
polpa viva (Hess 1917).
Nel momento in cui le difese dell’ospite perdono la possibilità di
accedere allo spazio canalare, microrganismi opportunisti, selezionati
dalle condizioni ambientali sfavorevoli e dalla carenza di ossigeno,
colonizzano il sistema canalare (Nair 2004). Queste comunità batteriche
possono sopravvivere in presenza di residui di tessuto pulpare e di
essudazione di origine parodontale (Sundqvist 1994, Love 2001).
Conseguentemente, in canali necrotici e in canali già trattati con
esito negativo le colonie di microrganismi si trovano tipicamente
nell’area apicale, dove possono avere contatto con i fluidi tissutali
(Nair 2004). In infezioni persistenti da lungo tempo, i batteri
presenti nel canale radicolare possono penetrare nei tubuli dentinali
adiacenti (Shovelton 1964, (. Armitage 1983). Le infezioni iniziali
sono polimicrobiche, tipicamente dominate
da anaerobi obbligati (Sundqvist 1994). I microrganismi più
frequentemente isolati prima del trattamento sono bastoncelli anaerobi
Gram-, cocchi anaerobi Gram+, bastoncelli Gram+ anaerobi e anaerobi
facoltativi, Lactobacilli e Streptococchi Gram+ anaerobi facoltativi
(Sundqvist 1994). Gli anaerobi obbligati sono piuttosto facilmente
eliminati durante il trattamento. Viceversa, batteri anaerobi
facoltativi come gli Streptococchi non- mutans, gli Enterococchi e i
Lactobacilli, una volta che hanno colonizzato il canale radicolare,
sono maggiormente in grado di resistere alla preparazione
chemio-meccanica e alle medicazioni canalari (Chavez et al.
2003). In particolare, l’Enterococcus Faecalis è stato segnalato come
abitualmente presente in canali precedentemente trattati con esito
negativo (Engström 1964, Haapasalo et al. 1983). Anche miceti
sono stati isolati in canali all'apice dei quali è presente parodontite
apicale resistente al trattamento (Waltimo 1997).
E’ probabile che tutti i microrganismi in grado di colonizzare un
sistema canalare necrotico possano causare lesioni infiammatorie
periapicali. Gli Enterococchi possono sopravvivere in monocoltura, ma
causano solo lesioni minori (Fabricius et al. 1982). Certe
specie di Gram- dimostrano più virulenza (Sundqvist 1994). La membrana
esterna dei Gram- contiene endotossine, che sono presenti in tutti i
canali necrotici con lesioni periapicali (Dahlén & Bergenholtz
1980), e sono in grado di innescare una risposta infiammatoria persino
in assenza di batteri vivi (Dwyer & Torabinejad 1980). Per di più,
i livelli di endotossine nei canali necrotici sono positivamente
correlati alla sintomatologia clinica, come al dolore spontaneo e alla
sensibilità alla percussione (Jacinto et al. 2005).
La sopravvivenza di bastoncelli aenaerobi Gram- virulenti, così come la
possibilità che essi esprimano per intero il loro potenziale patogeno,
dipende dalla contemporanea presenza di altri batteri (Fabricius et
al. 1982). Queste aggregazioni di microrganismi in una matrice
polisaccaridica extacellulare adesa ad una superficie (in questo caso
la parete interna del canale) sono denominate biofilms (Costerton et
al. 1994). Esiste evidenza che microrganismi organizzati in questa
maniera sono di gran lunga meno suscettibili agli agenti antimicrobici
rispetto alle corrispettive forme planctoniche, che sono quelle
tradizionalmente usate per esaminare l’efficacia antimicrobica delle
sostanze in vitro (Nickel et al. 1985, Wilson 1996). Se un
brodo di coltura batterico inoculato viene sottoposto all’azione di una
soluzione antimicrobica, l’efficacia dell’agente può sembrare assai
convincente, simile a quella dei tests di diffusione in agar. Tuttavia,
nel sistema canalare i biofilms e la presenza di batteri all’interno
dei tubuli dentinali rendono la disinfezione molto più difficile, per
cui modelli sperimantali come blocchi standardizzati di dentina bovina
infetta (Haapasalo & Ørstavik 1987) o modelli in vivo appaiono
decisamente più validi rispetto ai protocolli sopra menzionati. Per di
più è stato dimostrato che le componenti organica ed inorganica della
dentina, che sono a contatto con l’irrigante durante la preparazione
chemio-meccanica, inibiscono la maggior parte degli agenti
antimicrobici (Portenier
et al. 2001).
E’ dunque assai probabile che gli effetti delle sostanze irriganti
siano notevolmente sovrastimati rispetto alla loro effettiva attività
nelle condizione date.
LA DETERSIONE MECCANICA
Lo
scopo principale della strumentazione canalare è ottenere una
detersione meccanica e la creazione di uno spazio utile a rimuovere le
sostanze antimicrobiche. Inoltre una buona sagomatura canalare
favorisce lo stretto contatto del materiale da otturazione con le
pareti dentinali, a sua volta utile a prevenire la ricolonizzazione
batterica (Schilder 1974). Si è tentato di effettuare il trattamento
endodontico evitando la strumentazione meccanica ed utilizzando
dispositivi in grado di creare il vuoto durante l'irrigazione con
ipoclorito di sodio (Lussi et al. 1993). Sebbene l’approccio
sia interessante, al momento il livello di detersione ottenuto con
metodi simili è tuttavia non adeguato all’impiego clinico (Attin et
al. 2002).
La strumentazione meccanica, d’altra parte, presenta essa stessa
inconvenienti.
In primo luogo implica la possibilità di incidenti tecnici In elementi
necrotici con radiotrasparenze periapicali, complicanze tecniche quali
perforazioni, fratture di strumenti, come fratture di strumenti ed
errori di preparazione con comseguente impossibilità di raggiungere la
regione apicale del canale, pesano sfavorevolmente sulla prognosi
(Kerekes & Tronstad 1979).
In secondo luogo, la strumentazione comporta la stratificazione di
smear-layer sulle pareti canalari (McComb et al. 1976). Lo
smear-layer comprende una componente organica ed una inorganica, e in
particolare residui dentinali e pulpari (Gwinnett 1984). Lo smear-layer
può essere colonizzato da batteri (Akpata & Blechman 1982), e può
offrire protezione ai biofilms adesi alla parete canalare (Sen et
al. 1999). Inoltre la presenza di smear-layer ostacola
l’adattamento dei cementi endodontici alla parete del canale (Kokkas et
al. 2004) e può quindi favorire l’infiltrazione batterica
(Clark-Holke et al. 2003).
In terzo luogo, la strumentazione meccanica in combinazione con una
soluzione inerte (fisiologica, ad esempio) non è in grado di ridurre
adeguatamente il numero di batteri vivi in un sistema canalare infetto
(Grahnén & Krasse 1962, & Sundqvist 1981), e nemmeno di
evitare che si stratifichi smear-layer sulle pareti canalari (Mayer et
al. 2002). Sia impiegando gli attuali strumenti rotanti in Ni-Ti,
che preparando in modo tradizionale con strumenti manuali in acciaio,
circa metà della superficie delle pareti canalari rimane non preparata
(Peters 2004).
GLI
IRRIGANTI CANALARI
Storicamente,
per irrigare i canali radicolari è stato proposto un gran numero di
soluzioni acquose, dalla soluzione fisiologica a preparati contenenti
una sostanza antibatterica altamente tossica ed allergenica come la
formaldeide (Harrison 1984). Il numero delle soluzioni irriganti in uso
attualmente è però assai ristretto.
Idealmente una soluzione irrigante dovrebbe esercitare una azione
antibatterica a largo spettro, ed essere altamente efficace nei
confronti dei microrganismi anaerobi obbligati e facoltativi
organizzati in biofilms. Dovrebbe inattivare le endotossine ed essere
in grado di dissolvere il tessuto pulpare necrotico. Dovrebbe prevenire
la formazione di smear-layer durante la strumentazione, e dovrebbe
poterlo rimuovere quando già stratificato. Inoltre, dal momento che
entrano in contatto con tessuti vitali, gli irriganti canalari
dovrebbero essere privi di tossicità e di potere caustico nei confronti
dei tessuti parodontali, e dovrebbero essere incapaci di innescare una
reazione anafilattica.
Sebbene le sostanze iodate siano meno tossiche ed irritanti per i
tessuti vitali rispetto all’ipoclorito di sodio ed alla clorexidina
(Spångberg et al. 1973, Spångberg et al. 1979), hanno
maggior probabilità di provocare reazioni allergiche (Popescu et al.
1984). Lo stesso vale per i composti derivati dall’ammonio quaternario
(Baldo & Fisher 1983, Bernstein 1994). Invece, fenomeni di sensibilizzazione
all’ipoclorito e alla clorexidina sono rari ( Hostynek et al. 1989,
Krautheim et al. 2004). Nonostante il suo impiego sia
estremamente diffuso, sono riportati pochi casi di reazione allergica
all’ipoclorito usato come irrigante canalare (Caliskan et al. 1994).
Tra tutti gli irriganti usati attualmente, l’ipoclorito di sodio
risulta quello che possiede in maggior misura i requisiti utili.
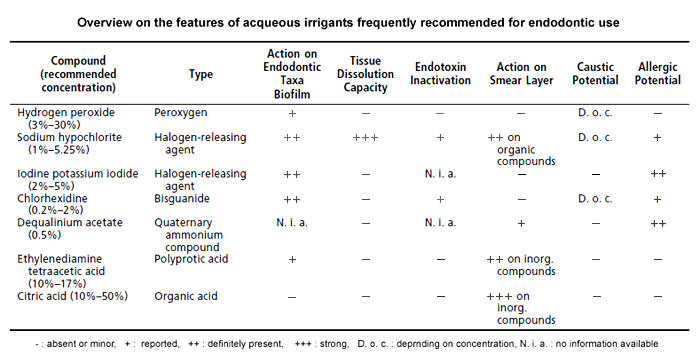
From: Zehnder M. Root canal
irrigants. J Endod. 2006; 32: 389-98.
L’ipoclorito è l’unico irrigante ad avere la capacità di dissolvere il
tessuto necrotico (Blum 1921) (Grossman & Meiman 1941) (Naenni et al. 2004) e le componenti organiche
dello smear-layer (Koskinen et al. 1980, Baumgartner &
Mader 1987, Gutierrez et al. 1990, Haikel 1994). Inoltre uccide batteri
sessili organizzati in biofilms e indovati nei tubuli dentinali con la
stessa efficacia della clorexidina e dei composti iodati , a
concentrazioni comparabili (Spratt et al. 2001, Ørstavik &
Haapasalo 1990, Vahdaty et al. 1993). L’inattivazione di
endotossine da parte dell’ipoclorito è stata riportata (Sarbinoff et
al. 1983, Silva et al. 2004), ma si tratta di un’azione
meno efficace di quella prodotta dall’idrossido di calcio (Tanomaru et
al. 2003).
Al di là del fatto che l’ipoclorito rappresenta l’irrigante di prima
scelta, vi sono tuttavia situazioni in cui anche altre soluzioni
possono rendersi utili.
CLOREXIDINA
La clorexidina fu prodotta per
la proima volta nei laboratori delle Imperial Chemical Industries Ltd.
(Macclesfield, England). Furono inizialmente sintetizzate una serie di
polibisguanidi per ottenere sostanze anti-virali. Esse tuttavia
dimostrarono una azione anti-virale scarsa, e furono accantonate, per
poi essere riconsiderate alcuni anni più tardi come agenti
antibaterici. La clorexidina era la più efficace tra le bisguanidi
testate (Davies et al. 1954). La clorexidina è una base forte
ed è più stabile in forma di sale. I sali originali furono la
clorexidina acetato e la clorexidina idrocloridrato. Entrambi erano
però poco solubili in acqua (Foulkes 1973), e furono rimpiazzati dalla
clorexidina digluconato. La clorexidina è un potente antisettico,
largamente usato in soluzione acquosa a concentrazioni dello 0.1-0.2 %
per contrastare la formazione di placca batterica in cavo orale (Addy
& Moran 2000). La concentrazione al 2% è invece usata per
l’irragazione canalare (Zamany et al. 2003). Si crede
comunemente che la clorexidina sia meno caustica dell’ipoclorito di
sodio (Jeansonne & White 1994), ma questa convinzione è infondata.
Una soluzione di clorexidina al 2% e irritante per la cute (Foulkes
1973). Anche le soluzioni di clorexidina, come quelle di ipoclorito di
sodio, se usate a minori concentrazioni ma riscaldate, agiscono più
efficacemente nel sistema canalare ed esprimono una minor tossicità
sistemica (Evanov 2004).
Nonostante la sua utilità come irrigante “finale”, la clorexidina non
può essere considerata irrigante di elezione nelle situazioni
ordinarie, poiché non dissolve il tessuto necrotico (Naenni
et al. 2004) ed è meno efficace sui batteeri Gram- che sui batteri
Gram+ (Davies et al. 1954, ) (Hennessey 1973, Emilson 1977).
Questo può spiegare perché l'impiego prolungato di clorexidina sui cani
conduce ad una prevalenza di bastoncelli Gram- nella placca (Hamp &
Emilson 1973). Deve essere considerato che molti studi in vitro
impiegano denti estratti bovini o umani mono- infettati con Enteroccus
Faecalis, che è un batterio Gram+ anaerobio facoltativo spesso presente
in canali già trattati con esito negativo (Portenier 2003). Ma
nelle infezioni primitive, che sono usualmente poli-microbiche, i Gram-
anaerobi predominano (Sundqvist 1994). Gli Enterococchi sono raramente
presenti nelle infezioni primarie (Siqueira et al. 2002).
L’efficacia della clorexidina nei confronti dei Gram+ nei tests di
laboratorio può indurre a sovrastimare l’utilità clinica della
sostanza. In uno studio clinico randomizzato, che confrontòa
l’efficacia della clorexidina al 2% e dell’ipoclorito di sodio al 2.5%
nel ridurre il numero di microrganismi all’interno del canale
radicolare, fu rilevato che l’ipoclorito era significativamente più
efficace della clorexidina nel produrre colture negative (Ringel et
al. 1982). Questo era soprattutto vero in presenza di anaerobi
obbligati, mentre la differenza era meno significativa se venivano
considerati gli anaerobi facoltativi. Inoltre il passaggio da coltura
negativa a positiva, valutato con prelievi in momenti successivi, fu
più frequente con clorexidina che con ipoclorito. Gli autori
interpretarono il fenomeno in ragione della incapacità della
clorexidina di dissolvere i residui di tessuto necrotico e di ripulire
chimicamente il sistema canalare.
Il Cetrexidin (GABA Vebas,
Roma, Italy ) è una soluzione irrigante che associa clorexidina allo
0.2% e cetrimide allo 0.2%. La cetrimide è un derivato
dell'ammonio quaternario, ovvero un tensioattivo cationico con
proprietà antisettiche, detergenti, emulsionanti.
IPOCLORITO
DI SODIO (NaOCl)
Il cloro
è uno degli elementi più largamente presenti in natura, dove non si
trova allo stato libero, ma esiste in combinazione con sodio, potassio,
calcio, e magnesio (Dychdala 1991). Nel corpo umano i composti del
cloro fanno parte delle difese immunitarie aspecifiche. Essi sono
generati dai neutrofili attraverso la clorazione
mieloperossidasi-mediata di un composto azotato, o di gruppi di
composti azotati (Test et al. 1984).
L’ipoclorito di potassio fu la prima soluzione acquosa clorata prodotta
chimicamente, in Francia, su formulazione di Berthollet (1748-1822). A
partire dalla fine del XVIII secolo, la soluzione fu prodotta
industrialmente da Percy a Javel, vicino a Parigi, da cui la
denominazione di “Acqua di Javel”. Dapprima le soluzioni di ipoclorito
furono usate come agenti sbiancanti. Successivamente l’ipoclorito fu
raccomandato da Labarraque (1777-1850) per prevenire la febbre
puerperale ed altre malttie infettive. In conseguenza degli studi di
laboratorio di Koch e Pasteur, l’ipoclorito venne largamente utilizzato
come disinfettante a partire dalla fine del XIX secolo. Durante la I
guerra mondiale, il chimico Henry Drysdale Dakin e il chirurgo Alexis
Carrel estesero l’impiego di soluzioni tamponate allo 0.5% di
ipoclorito di sodio all’irrigazione di ferite infette, basandosi sugli
studi meticolosi di Dakin che aveva valutato l’efficacia di diverse
soluzioni sui tessuti necrotici infetti (Dakin 1915).
Le
preparazioni di ipoclorito, accanto all’efficacia battericida a largo
spettro, possiedono capacità virucida (McDonnell & Russell 1999), e
riescono a dissolvere i tessuti necrotici molto più efficacemente dei
tessuti vitali (Austin & Taylor 1918). Per di più, le soluzioni di
ipoclorito di sodio hanno basso costo, sono facilmente disponibili, e
rimangono attive sufficientemente a lungo (Frais &
Gulabivala 2001). Queste caratteristiche fecero sì che l’ipoclorito di
sodio in soluzione acquosa divenisse l’irrigante di scelta in
Endodonzia fin dal 1920 (Crane 1920.).
|
Austin & Taylor
(1918) e Taylor & Austin (1918) dimostrarono l’azione solvente
della soluzione di Dakin sui tessuti non vitali, e notarono che la
stessa soluzione induceva solamente un modesto grado di infiammazione
sui tessuti normali. Crane (1920) fu il primo ad usare l'ipoclorito di
sodio come irrigante canalare.
Grossman & Meiman
(1941) dichiararono che l'NaOCl era piu efficace come solvente della
polpa rispetto all' idrossido di potassio, all'idrossido di sodio,
all'acido solforico e all'acido idrocloridrico.
|
Sono
stati proposti per l’uso endodontico altri composti che rilasciano
cloro, come la cloramina-T e il dicloroisocianurato di sodio
(Lambjerg-Hansen et al. 1982, Heling et al. 2001).
Tuttavia queste preparazioni non hanno mai avuto impiego esteso in
Endodonzia, e sono riesultate meno efficaci dell’ipoclorito a pari
concentrazioni (Naenni et al. 2004, Dychdala 1991, Van
Klingeren
et al. 1980).
Tra le diverse caratteristiche che idealmente un irrigante canalare
dovrebbe possedere, l’ipoclorito di sodio manca della capacità di
rimuovere i residui inorganici, e quindi lo smear-layer. Ma è in grado
di fornire tutta la rimanente azione utile, e in particolare è in grado
di esercitare una forte azione antibatterica (Olgart 1969, Shih 1970)
e un marcato effetto solvente sulla sostanza organica (Senia et al.
1971 ). Buttler & Crawford (1982) segnalarono inoltre la
capacità delle soluzioni di NaOCl di distruggere le endotossine
batteriche.

L’ipoclorito deve le due
sue azioni peculiari, capacità antibatterica e azione solvente, al pH
fortemente basico ed alla percentuale di cloro libero in soluzione. Va notato che la
quantità di cloro libero in una soluzione di ipoclorito si riduce con
il trascorrere del tempo per la presenza di ioni calcio. Questo succede
soprattutto nei preparati commerciali per uso domiciliare, che non sono
stabilizzati.
L’attività dell’ipoclorito di sodio si realizza quando, venendo a
contatto con l'acqua, libera acido ipocloroso ed idrossido di sodio.
L'acido ipocloroso, a sua volta, libera acido cloridrico ed ossigeno
(Siqueira et al. 2002). Il cloro libero svolge la sua azione
battericida entrando in combinazione con i principali costituenti
protoplasmatici, in particolare con le proteine
(Penick &
Osetek 1970). Questo legame del cloro con le proteine, se da un
lato costituisce il fondamento dell’azione dell’irrigante, dall’altro
ha come conseguenza il fatto che l’efficacia della soluzione si
esaurisce man mano che il cloro libero viene legato. Ne consegue che
durante la fase di detersione è necessaria la frequente reintroduzione
di nuova soluzione nel canale, in quanto la presenza di materiale
organico, in funzione diretta della quantità di questo, esaurisce
progressivamente la quantità di cloro disponibile e quindi l’azione
della soluzione.
Il cloro attivo in soluzione acquosa a temperatura ambiente può, in
sostanza, essere utilizzato in due forme: ipoclorito (OCl- )
o acido ipocloroso (HOCl). La concentrazione di entrambi può essere
espressa come cloro disponibile determinando il potenziale
elettrochimico equivalente del cloro elementare (Dychdala 1991).
Cl2 + 2e- = 2Cl-
OCl- + 2e- + 2H+ = Cl- + H2O
Perciò una mole di ipoclorito contiene 1 mole di cloro disponibile. Lo
stato del cloro disponibile dipende dal pH della soluzione. Sopra pH
7.6 la forma prevalente è l’ipoclorito, sotto questo valore la forma
prevalente è l’acido ipocloroso (Smith & Martell 1976).
Entrambe le forme sono agenti ossidanti estremamente reattivi. Le
soluzioni pure di ipoclorito che sono usate in Endodonzia hanno pH 12
(Frais et al. 2001), e tutto il cloro disponibile è in forma di
OCl- . Tuttavia, a identici livelli di cloro disponibile, l’acido
ipocloroso hsa maggior potere battericida dell’ipoclorito (Bloomfield
& Miles 1979). Un modo per aumentare l’efficacia delle soluzioni di
ipoclorito potrebbe quindi essere abbassarne il pH. Si è anche
ipotizzato che queste soluzioni siano meno tossiche per i tessuti
vitali rispetto alle soluzioni tamponate (Dakin 1915, Cotter et al.
1985). Tuttavia, tamponare la soluzione con bicarbonato rende instabile
la soluzione, che si inattiva in meno di una settimana (Cotter et
al. 1985). In relazione alla quantità di bicarbonato presente, e
perciò del valore del pH, l’efficacia antimicrobica di una soluzione
fresca tamponata con bicarbonato è solo leggermante maggiore (Cotter et
al. 1985) o sostanzialmente simile (Zehnder et al. 2002)
rispetto alle soluzioni non tamponate. Infine, il potenziale caustico
delle soluzioni di ipoclorito appare essere influenzato principalmente
dal cloro disponibile piuttosto che dal pH o dall’osmolarità (Zehnder et
al. 2002).
Ci sono stati, e ci sono
ancora, pareri controversi circa la concentrazione delle soluzioni di
ipoclorito da usare in Endodonzia. Dal momento che la soluzione di
ipoclorito di sodio originale di Dakin allo 0.5% era destinata a
trattare ferite (ustioni) aperte, è stato ipotizzato che in uno spazio
minimo come quello del sistema canalare dovessero essere usate
concentrazioni più alte, poichè sarebbero state più efficaci (Grossman
1915).
Il potere antibatterico dell’ipoclorito in soluzione acquosa e la sua
capacità di dissolvere il tessuto necrotico sono funzione della sua
concentrazione, e quindi della sua tossicità (Spångberg et al.
1973). Negli USA la maggioranza degli odontoiatri usa ipoclorito “a
piena concentrazione“ al 5.25%, così come è venduto per uso domestico
(Zehnder 2006). Tuttavia, sono stati segnalati fenomeni irritativi in
casi in cui è stato spinto nel periapice sotto pressione, o in casi di
passaggio in cavo orale (Hülsmann & Hahn 2000). In aggiunta, è
stato riportato che le soluzioni al 5.25% provocano riduzione del
modulo di elasticità e della resistenza alla flessione della dentina
umana significativamente superiore a quella prodotta da soluzione
salina, e che questa riduzione che non si verificherebbe con soluzioni
allo 0.5% (Sim et al. 2001). Questo potrebbe derivare
dall’azione proteolitica dell’ipoclorito concentrato sulle fibre
collagene della matrice organica della dentina. La riduzione dei
microrganismi all’interno del canale, d’altra parte, non sarebbe molto
maggiore impiegando ipoclorito al 5.25% piuttosto che al lo 0.5% (Cvek et
al. 1976, & Sundqvist 1985). Da ossevazioni in vitro
sembrerebbe che soluzioni di ipoclorito all’1% siano sufficientemente
efficaci da dissolvere tutti i residui pulpari nel corso di una seduta
operativa (Sirtes et al. 2005). Si deve essere consapevoli del
fatto che, durante le fasi successive di irrigazione, viene
continuamente immesso nel sistema canalare ipoclorito fresco, e che
quindi la concentrazione della soluzione può non giocare un ruolo
decisivo (Moorer & Wesselink 1982). Aree non deterse possono essere
il risultato della incapacità delle soluzioni di raggiungere
fisicamente le aree stesse, piuttosto che della concentrazione
insufficiente (Senia et al. 1971). Basandosi sui dati
dell’evidenza disponibili, non vi sarebbe ragione di utilizzare
soluzioni di ipoclorito a concentrazioni superiori all’1% in
peso/volume. Ma la letteratura riporta pareri assai controversi a
riguardo.
Dal momento che tanto la capacità solvente, come il potere battericida
dell’ipoclorito di sodio, dipendono dalla concentrazione della
soluzione usata, si è cercato di individuare la concentrazione (in un
range tra lo 0.5% e il 10%) ideale di utilizzo dell’ipoclorito,
allo scopo di definire valori di compromesso tra la maggiore efficacia
da un lato e l'azione meno lesiva possibile sui tessuti periapicali
dall'altro, e molti sono anche gli studi che hanno valutato gli effetti
dell’impiego combinato di ipoclorito di sodio e di altri agenti
irriganti, ma con totale discordanza di risultati e di opinioni. Tra
l'altro gli studi sono condotti con protocolli diversi e su substrati
differenti, per cui sono spesso mal confrontabili. Ad esempio, il
potere solvente è stato valutato in vitro su polpa umana (denti
estratti), ma anche polpa bovina, tendini bovini, tessuto muscolare di
maiale, parete addominale di topo, in frammenti di varia dimensione,
con o senza agitazione, con o senza triturazione meccanica.
Permane discordanza di pareri circa la
concentrazione ideale di utilizzo. L'equilibrio da trovare è fra
concentrazioni più alte capaci di aumentare l'efficacia dell'azione
battericida e solvente, e concentrazioni più basse caratterizzate da
una riduzione dell'effetto tossico e irritante delle soluzioni. Vi è
discordanza incrociata anche sulla fondatezza di questi timori, poichè
molti studi sottolineano l'innocuità delle alte concentrazioni, ed
altri l'efficacia delle basse concentrazioni.
|
Shih et al.
(1970) riportarono che l'NaOCl al 5.25% era germicida in 30 secondi su
Streptococcus Faecalis e Staphilococcus Aureus, batteri comunemente
presenti in canali infetti e resistenti alle medicazioni intracanalari,
ma lo era anche in concentrazioni dello 0.5%, 0.05% e 0.005%.
Spangberg et al. (1973) osservarono
che in caso di necrosi capace di portare i batteri all'interno del
tubuli era utile un irrigante ad azione antimicrobica; dichiararono che
l'NaOCl al 5% era tossico in vitro, e che l'NaOCl allo 0,5% (pH
8,9) dissolveva i tessuti necrotici e non quelli vitali; dichiararono quindi
sconsigliabile una concentrazione del 5% ritenendola tossica per le
cellule, e suggerirono una concentrazione allo 0.5%; a tale
concentrazione la capacità solvente era ridotta, ma l’azione
battericida veniva mantenuta.
Nicholls (1977) propose
una concentrazione all'1%, in contrasto con quanto riportato da altri
studi (Svec & Harrison 1977, Trepagnier et al. 1977)
secondo i quali, invece, sotto l'1% ed in particolare allo 0,5% non era
possibile dissolvere polpa necrotica nemmeno dopo abbondanti e ripetute
irrigazioni.
Trepagnier et al. (1977)
rilevarono che i1 maggior grado di dissolvimento della polpa da parte
dell'ipoclorito di sodio avveniva entro pochi minuti.
Svec & Harrison
(1977) riscontrarono efficace l'azione solvente dell'ipoclorito di
sodio al 2.5% e al 5%, non efficace se a concentrazione dello 0.5%.
Hand et al. (1978)
riportarono che soluzioni al 5.25% di ipoclorito di sodio esprimevano
la massima capacità antibatterica e solvente sul tessuto pulpare.
Thè nel 1979 effettuò uno studio su topi e concluse che la
concentrazione al 3% era quella con cui si otteneva la maggiore
dissoluzione di ltessuto necrotico entro i 30 minuti.
Koskinen et al. (1980)
valutarono l'efficacia di soluzioni tra lo 0.5% ed il 5% e rilevarono
un maggior effetto solvente impiegando soluzioni tra il 2.5 e il 5%.
Harrison et al. (1981)
rilevarono i che l'NaOCl al 5%, se usato con proprietà, non provocava
più dolore post-operatorio di una soluzione salina, e che era il
piu efficace nella rimozione di residui pulpari a detriti dentinali tra
gli irriganti impiegati.
|
Un approccio alternativo
per aumentare l’efficacia nel sistema canalare delle soluzioni
irriganti di ipoclorito potrebbe essere aumentare la temperatura di
soluzioni di NaOCl a bassa concentrazione. L’aumento di temperatura
migliora la capacità immediata di dissolvere i tessuti (Thé 1979,
Cunningham & Balekjian 1980, Abou-Rass & Oglesby 1981).
Inoltre, le soluzioni calde di ipoclorito rimuovono meglio i detriti
organici dai trucioli di dentina rispetto alle soluzioni non riscaldate
(Kamburis et al. 2003). Anche le proprietà antimicrobiche delle
soluzioni riscaldate di ipoclorito sono state oggetto di discussione.
Fin dal 1936 fu dimostrata l’influenza della temperatura
dell’ipoclorito sulla sopravvivenza del Micobacterium Tubercolosis
(Costigan 1936). Con le specie testate finora, il potere battericida
delle soluzioni di ipoclorito è risultato più che raddoppiato per ogni
incremento termico di 5°C, in un intervallo di temperature compreso fra
i 5 °C e i 60 °C (Dychdala 1991).
Questo dato fu confermato in uno studio in cui furono utilizzate
cellule batteriche di Enterococcus Faecalis in stato stabile
planctonico; un incremento di temperatura di 25°C provocava un aumento
dell’efficacia di un fattore 100 (Sirtes et al. 2005). La
capacità di dissolvere polpa dentale umana dell’ipoclorito all’1% a
temperatura di 45 °C fu trovata uguale a quella dell’ipoclorito al
5.25% a 20 °C (Sirtes et al. 2005). D’altra parte, con una
efficacia simile a breve termine nel sistema canalare, la tossicità
sistemica di soluzioni di NaOCl riscaldate dovrebbe essere inferiore
rispetto a quella di soluzioni più concentrate non riscaldate, poiché
la temperatura di equilibrio è raggiunta piuttosto rapidamente
(Cunningham & Balekjian 1980). Tuttavia non vi sono al momento
studi clinici disponibili a supporto definitivo dell’impiego
dell’ipoclorito riscaldato.
|
Thè (1979) dimostrò che
portando la temperatura dell'ipoclorito di sodio a 35.5°C era possibile
ottenere un notevole incremento della sua capacità di dissolvere il
tessuto connettivo di ratto. In accordo con questi risultati Cunningham et al. (1980)
confrontarono soluzioni di ipoclorito di sodio al 2.6% ed al 5.2% per
valutare la capacità di dissolvere collagene bovino a temperatura
ambiente (21°C) ed a temperatura corporea (37°C); conclusero che
l'ipoclorito di sodio al 2.5% a 37°C aveva potere dissolvente
equivalente alla soluzione al 5% a 21°C; la soluzione di NaoCl era
stabile al riscaldamento per 4 ore, e dopo 24 ore si alterava
nettamente.
I
medesimi autori
(Cunningham et al. 1980) in un altro studio conclusero
che l'aumento di temperatura non influenzava, invece, l'attività
battericida, che rimaneva la medesima utilizzando l'ipoclorito di sodio
al 5.2% sia a 21°C che a 37°C.
Cunningham
& Joseph, tuttavia, esaminarono l'azione battericida
dell'ipoclorito di sodio al 2.6% a 22°C e a 37°C su batteri selezionati
(Staphilococcus Aureus, Streptococcus Sanguis, Eschirichia Coli,
Proteus Vulgaris, Bacillus Subtilis Spores), e conclusero che a 37°C la
sterilità veniva raggiunta in un tempo significativamente minore.
|
Un aspetto da
considerare è che la massima azione solvente dell'ipoclorito si ottiene
quando è possibile realizzare un contatto molto stretto con il
materiale organico.
|
Shih et al. (1970) sottolinearono
l'assenza di relazione fra attività battericida in vitro e in
vivo, poichè il materiale organico poteva impedire il pieno
contatto fra NaOCl e germi, ovvero neutralizzare lo stesso NaOCl.
Senia et al.
(1971) affermarono che l'NaOCl aveva necessità di ampia superficie di
contatto per dissolvere la polpa, e che frammenti di polpa indovati in
anfratti o in corrispondenza di un istmo erano al riparo da questa
azione; inoltre osservarono che poco NaOCl raggiungeva la regione
apicale, e che l'ipoclorito era piu efficace dove il canale era piu
ampio.
Gordon et
al.
(1981), valutando diverse concentrazioni di ipoclorito di sodio
riguardo alla capacità solvente, sottolinearono l'importanza dell'area
di contatto tra gli irriganti e il materiale organico e suggerirono che
la presenza di sistemi canalari complessi con istmi e ramificazioni era
un fattore capace di influenzare il tempo d'azione necessario,
aumentandolo.
Hasselgren (1988) giunse
alle stesse conclusioni.
|
La strumentazione meccanica, per l'effetto di triturazione della polpa,
è in grado di contribuire ad aumentare la superficie di contatto fra
l'irrigante ed il tessuto.
|
Shih et al. (1970) dichiararono che la strumentazione meccanica
non era di per sè in grado di eliminare i batteri dal canale;
aggiunsero che la coltura
negativa non indicava sterilità ma piuttosto riduzione marcata del
numero dei batteri residui, i quali, annidati nei tubuli, tendevano se
non incarcerati, a moltiplicarsi nuovamente nel lume del canale;
affermarono la necessità di una medicazione canalare fra una seduta
operativa e l'altra.
|
E’ stata anche
consigliata l’attivazione ultrasonica dell’ipoclorito di sodio, per
“accelerare le reazioni chimiche, creare effetti di cavitazione, e
produrre una più efficace detersione” (Martin 1976). Tuttavia i
risultati ottenuti comparando l’impiego di ipoclorito attivato
ultrasonicamente con l’impiego convenzionale in assenza di ultrasuoni
sono contradditori, sia per quanto concerne la pulizia ottenuta del
canale (Ahmad et al. 1987, Abbott et al. 1991, Cheung
& Stock 1993, Jensen et al. 1999) che per quanto riguarda
la riduzione del numero dei microrganismi rimasti nel sistema canalare
dopo le procedure di detersione e sagomatura (Barnett et al.
1985, Sjögren & Sundqvist 1987). Gli effetti osservati
dell’attivazione ultrasonica, se presenti, sono stati riscontrati
relativamente scarsi. Inoltre, la natura di questi effetti non è chiara
(Walmsley 1987). E’ stato suggerito l’impiego di un file endosonico N°
15 ISO, connesso a un manipolo ultrasonico e portato alla distanza di 1
mm dall’apice, per ottenere attivazione passiva dell’irrigante (Martin
H, Cunningham W. Endosonics—the ultrasonic synergistic system of
endodontics. Endod Dent Traumatol 1985; 1: 201-6.). Usando questi
dispositivi in prove di laboratorio, non fu osservato alcun fenomeno di
cavitazione in recipienti rettangolari in vetro (Ahmad et al.
1987). Per cui l’attivazione dell’ipoclorito fu attribuita
principalmente al flusso sonico (acustico), cioè al movimento di
fluidi, simile a quello provocato da vortici, che si verificava vicino
al file endosonico (Ahmad et al. 1987). D’altra parte, in
canali radicolari simulati, sia flusso acustico che cavitazione stabili
possono verificarsi in grado variabile, in relazione al contatto fra il
file e le pareti canalari (Roy et al. 1994). Tuttavia, le
modalità di attuazione del flusso acustico nell’ambiente ristretto del
sistema canalare, con la sua complessa superficie interna e i patterns
imprevedibili delle riflessioni d’onda , rimangono non chiarite (Krell
& Johnson 1988) . In nessuno degli studi citati sono state
controllate le temperature delle soluzioni. Gli ultrasuoni producono
calore (Nyborg 1965), e potrebbero semplicemente per questo rendere
l’ipoclorito leggermente più attivo. Nondimeno, un diretto effetto
ultrasonico sulla detersione canalare è stato riportato (Van der Sluis et
al. 2005). Se deve essere utilizzata attivazione ultrasonica
dell’ipoclorito, è importante che lo strumento ultrasonico sia
impiegato dopo che la preparazione del canale è stata ultimata. Uno
strumento libero di oscillare nella soluzione irrigante produrrà più
effetti ultrasonici di uno strumento bloccato tra le pareti del canale
(Roy et al.
1994). Per di più, i files ultrasonici possono causare
un’azione di taglio incontrollata sulle pareti canalari, specialmente
se usati durante la preparazione (Stock 1991). Per cui appare
preferibile inserire un sottile strumento non tagliente in modo
controllato solo dopo che la preparazione del canale è stata terminata
(Mayer et al. 2002) (Van der Sluis et al. 2005).
Recentemente sono stati resi disponibili inserti lisci da utilizzare
con dispositivi ultrasonici. Non sono ancora disponibili dati a
riguardo.
Dovrebbe essere preso in considerazione il fattore “tempo” (Sjögren
& Sundqvist 1987), quando si considera l'irrigazione durante
l’attività clinica. Persino sostanze antibatteriche ad azione rapida
come l’ipoclorito di sodio richiedono un adeguato tempo di contatto per
produrre i loro effetti (Peters 2004). Ciò dovrebbe essere considerato
soprattutto in relazione al fatto che le tecniche di preparazione
rotante con strumenti in Ni-Ti hanno reso più veloce la preparazione
del canale (McDonnell & Russell 1999). Il tempo ideale di
permanenza nel sistema canalare di una soluzione di ipoclorito ad una
determinata concentrazione non è stato ancora stabilito.
|
Curiosamente,
Senia et al. (1971) affermarono che il prolungamento del tempo
di irrigazione con ipoclorito di sodio da 15 a 30 min non migliorava il
risultato.
|
Un altro parametro
da considerare per la valutazione dei tempi d'azione dell'irrigante è
il tipo di tessuto presente (Abou-Rass
et al. 1981): infatti
il tessuto fresco si dissolve rapidamente, il tessuto necrotico
richiede più tempo, ma soprattutto il tessuto fissato (ad esempio con
prodotti a base di formaldeide o paraclorofenolo) richiede molto tempo
per essere dissolto.
|
|

|
|
Polpa fresca
|
Polpa fissata
|
Per quanto concerne l’uso
combinato di ipoclorito di sodio ed altre soluzioni irriganti, sono
state espresse opinioni favorevoli (Grossman 1970,
1981) all'effettuazione di lavaggi canalari alternati di NaOCl e di H2O2.
Ma è stato anche sostenuto (Thè 1979) che l'uso alternato di ipoclorito
di sodio e di perossido di idrogeno riduce notevolmente l'attività
della prima sostanza.
|
Senia et al.
(1971) rilevarono, in seguito all'uso alternato di
H2O2 e di NaOCl, una diluizione
dell'ipoclorito di sodio con riduzione della sua capacità solvente;
osservarono
inoltre che l'effervescenza provocata dallla commistione fra H2O2
e NaOCl formava bolle di gas che riducevano la superficie di contatto
con i substrati organici.
Baker et al.
(1975) esaminarono, in 48 elementi monoradicolati strumentati
manualmente, l'azione di numerosi irriganti, impiegati singolarmente o
in associazione: NaOCl allo 0.5-1-3 %, soluzione fisiologica, perossido
di idrogeno al 3%, perossido di urea al 10% in combinazione con
glicerolo anidro, RC-Prep (perossido di urea al 10% + EDTA al 15%),
EDTA al 15%; osservarono liberazione di ossigeno per contatto fra H2O2
ed NaOCl, e fra RC-Prep ed NaOCl; residuavano piu detriti nelle aree
coronali; l'NaOCl all'1% non dissolveva la polpa piu di altri
irriganti; gli agenti chelanti alteravano la morfologia della dentina;
piu detriti venivano rimossi da maggiori quantità di irrigante; un
soggiorno piu prolungato dell'irrigante non migliorava il risultato.
Thè (1979) immerse
campioni di tessuto necrotico di topo sia in soluzioni di ipoclorito di
sodio a diverse concentrazioni, sia alternativamente in ipoclorito di
sodio e acqua ossigenata; osservò che entro 30 minuti la soluzione più
efficace nella rimozione del tessuto necrotico era l'ipoclorito di
sodio al 3%, e che l'uso di questo alternato all'acqua ossigenata ne
riduceva notevolmente l'attività.
Svec &
Harrison (1981) osservarono che l'irrigazione alternata con NaOCl e con
sostanze ossigenate non forniva migliori risultati rispetto alla sola
irrigazione con NaoCl; si liberava tuttavia ossigeno nascente che
generava effervescenza, la quale a sua volta agiva sollevando detriti.
Hata (2001) rilevò che
l’irrigazione combinata con ipoclorito di sodio ed acqua ossigenata
producava nella rimozione dello smear layer effetti simili a quelli
ottenuti combinando l’azione dell'EDTA al 15 % con quella
dell'ipoclorito di sodio al 5%.
|

Ipoclorito di
Sodio - Chimica e Azione Disinfettante
PEROSSIDO
DI IDROGENO
Come
irrigante l'H2O2 è usata di solito al 3% e
possiede pertanto una blanda azione antibatterica. Un'altra sua
caratteristica è quella di possedere una debole azione sbiancante.
L'acqua ossigenata può però determinare un effetto irritante sui
tessuti a livello periapicale per la liberazione di O2 (Shiozawa
2000). L'impiego dell’acqua
ossigenata va quindi evitato nei denti con apice immaturo o con apice
riassorbito da un processo flogistico apico-periapicale. In presenza di
forame apicale di grande diametro esiste il rischio
di creare fenomeni di tipo enfisematoso con conseguente tumefazione e
dolore (Kaufman 1981).
Alcuni studi in letteratura hanno esaminato l'uso alternato di
l'ipoclorito di sodio e acqua ossigenata: il contatto fra le due
soluzioni, con conseguente liberazione di radicali OH- e di O2,
produce un’azione antibatterica oltre ad una effervescenza marcata;
quest’ultima consentirebbe un trasporto più efficace di detriti
rispetto a quanto si può ottenere con la sola H2O2
(Svec & Harrison 1981).
L’uso
combinato con l'ipoclorito comporta però anche la sommazione degli
effetti irritativi delle soluzioni ed un maggior rischio di fenomeni di
infiltrazione gassosa dei tessuti. Inoltre è opinione diffusa che
l’ipotetico vantaggio di un esaltato effetto antibatterico e solvente
derivante dall’uso contemporaneo dei due irriganti possa essere
vanificato dalla diluizione dell’ipoclorito con l’H2O2.
|
Senia et al.
(1971) rillevarono, in seguito all'uso alternato dei due irriganti, una
diluizione dell'ipoclorito di sodio con riduzione della sua capacità
solvente;
osservarono
inoltre che l'effervescenza provocata dallla commistione fra H2O2
e NaOCl formava bolle di gas the riducevano la superficie di contatto
con i substrati organici.
Baker et al.
(1975) esaminarono, in 48 elementi monoradicolati strumentati
manualmente, l'azione di numerosi irriganti, impiegati singolarmente o
in associazione: NaOCl allo 0.5-1-3 %, soluzione fisiologica, perossido
di idrogeno al 3%, perossido di urea al 10% + glicerolo anidro, RC-Prep
(perossido di urea al 10% + EDTA al 15%), EDTA al 15%; osservarono
liberazione di ossigeno per contatto fra H2O2 ed
NaOCl, e fra RC-Prep ed NaOCl; residuavano piu detriti nelle aree
coronali; l'NaOCl all'1% non dissolveva la polpa piu di altri
irriganti; gli agenti chelanti alteravano la morfologia della dentina;
piu detriti vengono rimossi da maggiori quantità di irrigante; un
soggiorno piu prolungato dell'irrigante non migliorava il risultato.
Thè (1979) immerse campioni di tessuto necrotico di topo sia in
soluzioni di ipoclorito di sodio a diverse concentrazioni, sia
alternativamente in ipoclorito di sodio e acqua ossigenata; osservò che
entro 30 minuti la soluzione più efficace nella rimozione del tessuto
necrotico era l'ipoclorito di sodio al 3%, e che l'uso di questo
alternato all'acqua ossigenata ne riduceva notevolmente l'attività.
Svec & Harrison
(1981) osservarono che l'irrigazione alternata con NaOCl e con sostanze
ossigenate non forniva migliori risultati rispetto alla sola
irrigazione con NaoCl; si liberava tuttavia ossigeno nascente che
generava effervescenza, la quale a sua volta agiva sollevando detriti.
Hata (2001) rilevò che l’irrigazione combinata con ipoclorito di sodio
ed acqua ossigenata produceva nella rimozione dello smear layer effetti
simili a quelli ottenuti combinando l’azione dell'EDTA al 15 % con
quella dell'ipoclorito di sodio al 5%.
|
CHELANTI
Sebbene
l’ipoclorito di sodio rappresenti l’irrigante di scelta, non può
dissolvere la componente inorganica della dentina e prevenire la
formazione di smear-layer durante la strumentazione del canale (Lester
& Boyde 1977).
Per di più, si incontrano
frequentemente nel sistema canalare calcificazioni che ostacolano la
strumentazione. Sono quindi stati raccomandati agenti demineralizzanti
come l’acido etilen-diamino-tetra-acetico (EDTA) (Nygaard Östby 1957) e
l’acido citrico (Loel 1975). Si tratta di agenti biocompatibili e
comunemente impiegati in prodotti per la cura della persona (Coons et
al. 1987). Sebbene l’acido citrico appaia leggermente più attivo
dell’EDTA a concentrazioni simili, entrambi gli agenti sono molto
efficaci nella rimozione dello smear-layer (Zehnder et al.
2005). Al di là della capacità pulente che sono in grado di esercitare,
i chelanti possono anche determinare il distacco di biofilms adesi alle
pareti canalari. Questo può spiegare perché un irrigante a base di EDTA
si sia dimostrato molto superiore alla soluzione salina nel ridurre la
flora microbica endocanalare (Yoshida et al. 1995), nonostante
il suo potere antisettico sia relativamente limitato (Patterson 1963).
Sebbene non vi siano prove scientifiche sula base di studi clinici
randomizzati, un protocollo di irrigazione che alterni NaOCl ed EDTA
può essere ragionevolmente ritenuto più efficace nel ridurre la carica
batterica rispetto alla sola soluzione salina ( & Sundqvist 1985).
Antisettici come derivati dell’amminio quaternario (EDTAC) (Nygaard
Östby 1957) o antibiotici come le tetracicline (MTAD) (Torabinejad et
al. 2003; 29: 170-5.) sono stati addizionati all’EDTA e all’acido
citrico, rispettivamente, per aumentare la loro efficacia
antimicrobica. Il valore clinico di queste associazioni, tuttavia, è
discutibile. L’EDTAC rimuove lo smear-layer con la stessa efficacia
dell’EDTA, ma l’EDTAC è più caustico (Patterson 1963). Per quanto
riguarda il MTAD, la resistenza alle tetracicline non è infrequente in
batteri isolati dai canali radicolari (Dahlén et al. 2000). In
generale, l’uso degli antibiotici al posto di agenti biocidi come
l’ipoclorito o la clorexidina risulta ingiustificato, dal momento che i
primi sono stati sviluppati in funzione dell’uso sistemico piuttosto
che per l'uso topico, ed hanno uno spettro d’azione di gran lunga più
limitato rispetto ai secondi (McDonnell & Russell 1999).
Gli agenti chelanti possono essere utilizzati in forma liquida o in
pasta (Hülsmann et al. 2003). Le preparazioni in pasta
risalgono al 1961, quando Stewart mise a punto una combinazione di
perossido di urea con glicerolo (Stewart 1961). Più tardi, sulla base
dei risultati di quel primo studio preliminare e della successiva
utilizzazione clinica dell’EDTA (Nygaard Östby 1957), il perossido di
urea e l’EDTA furono combinati utilizzando come veicolo il
polietilenglicole, solubile in acqua (Stewart et al. 1969).
Questo prodotto da allora è stato commercialmente disponibile. Paste
chelanti simili contenenti EDTA e perossidi sono state successivamente
prodotte da vari fabbricanti. Tuttavia, nessuna di queste paste
dovrebbe essere utilizzata, dal momento che non sono efficaci per
prevenire la formazione di smear-layer (Hülsmann et al. 2003).
Sorprendentemente, alcuni studi hanno riportato che, invece che ridurre
lo stress fisico sugli strumenti rotanti come è stato descritto, i
lubrificanti contenenti polietilenglicole o non avrebbero effetto o, in
dipendenza del disegno dello strumento, avrebbero effetto negativo
(Peters et al. 2005; 38: 223-9.).
Un aspetto importante relativo alle sostanze chelanti correntemente
disponibili, cioè EDTA e acido citrico, è che interagiscono
intensamente con l’ipoclorito di sodio (Baumgartner & Ibay 1987).
Tanto l’EDTA che l’acido citrico riducono immediatamente il cloro
disponibile in soluzione, rendendo l’ipoclorito di sodio inefficace su
batteri e tessuto necrotico (Zehnder et al. 2005). Per cui
l’acido citrico e l’EDTA non dovrebbero mai essere mescolati con
ipoclorito di sodio. Lo stesso vale per le preparazioni di EDTA in
pasta: in rapporto di 1:10, inattivano immediatamente tutto
l’ipoclorito di una soluzione all’1% (Girard et al. 2005).
L’effervescenza, che viene citata per giustificare l’uso combinato di
questi prodotti, dimostra solo che si verifica una reazione fra
ipoclorito di sodio da un lato, ed EDTA e perossido di idrogeno ( se
contenuto nel chelante in pasta) dall'altro, risultante
nell’evaporazione di gas (Baumgartner & Ibay 1987). L’ossigeno
evapora da soluzioni acquose in cui ipoclorito e perossido vengono in
contatto, e gas di cloro e ossigeno evaporano quando l’ipoclorito viene
in contatto con EDTA o acido citrico (Baumgartner & Ibay 1987). Non
è mai stato dimostrato che questa reazione produca un effetto fisico
detergente.
L’idrossietildienbifosfonato (HEBP), definito anche etidronato, è un
agente decalcificante che mostra solo una piccola interferenza a breve
termine con l’ipoclorito di sodio. E’ stato proposto come alternativa
possibile all’acido citrico o all’EDTA (Zehnder et al. 2005).
L’HERP previene l’assorbimento osseo ed è usato sistemicamente in
pazienti che soffrono di osteoporosi o Morbo di Paget (Russell &
Rogers 1999). Non vi sono al momento prove scientifiche che dimostrino
che questa sostanza può avere fornire contributo positivo
all’irrigazione, o ridurne la durata mantenendone l'efficacia.
|
LO
SMEAR-LAYER
Mc
Comb et al. (1975) furono tra i primi ricercatori a descrivere
lo smear-layer (fango dentinale). La formazione dello smear layer si deve
all’azione di taglio meccanico della dentina da parte degli strumenti
endodontici: i detriti prodotti si stratificano sulla superficie
interna delle pareti canalari (Goldman et al.
1981, 1982).
Lo smear-layer risulta costituito da due componenti:
- uno strato sottile di spessore medio di 1 o 2
mm che riveste le pareti canalari
- una componente che penetra all'interno dei tubuli dentinali
costituendo gli smear-plugs, tappi profondi circa 40 mm (Mader et al. 1984).
Sono comprese
nello smear-layer sia particelle organiche che particelle inorganiche.
La componente organica è rappresentata da tessuto pulpare vitale o
necrotico, batteri, processi odontoblastici e cellule ematiche (Mc Comb
et al. 1975, Goldman et al. 1982), mentre
la componente inorganica consiste in tessuto calcificato (Mc Comb et al. 1975,
Moodnik et al. 1977, Goldman et al. 1981, 1982).
Molte opinioni sono
state espresse sul possibile ruolo dello smear-layer e sulla necessità
o meno di una sua rimozione dalle pareti del canale radicolare.
Lester & Boyde (1977) affermarono che
lo smear-layer tendeva ad
occludere i tubuli, e che se si desiderava rimuoverlo andava impiegato
EDTA.
Se è vero che vi sono stati
sostenitori della necessità di non rimuoverlo, in quanto ritenuto
capace di un'azione isolante, di ostruzione dell'imbocco dei tubuli
dentinali e di impedimento alla penetrazione batterica (Vojinovic et al.
1973), va anche detto che opinioni successive hanno spesso
contraddetto questo orientamento. Fu ad esempio sostenuto (Olgart et al.
1974) che gli acidi prodotti dai microrganismi potessero
dissolvere lo smear-layer e consentire comunque la penetrazione nei
tubuli dentinali. Fu documentata all'interno dello smear-layer la
presenza di batteri e la loro moltiplicazione con produzione di tossine
(Brännström & Nyborg 1974). Fu anche considerata negativa la
presenza dello smear-layer in quanto ostacolo alla penetrazione nei
tubuli, e quindi all'azione, degli irriganti e di medicamenti
eventualmente introdotti nel canale (Mc Comb et al.
1975, Moodnik
et al. 1977,
Baumgartner
& Cuenin 1992). Del resto
William & Goldman (1985) dichiararono che lo smear-layer rallentava
solamente la penetrazione di microrganismi, senza quindi ostacolarla, e
che lo smear-layer che si trovava sulle pareti canalari dopo la
strumentazione endodontica poteva contenere residui di polpa necrotica
e batteri. Successivamente anche Orstavik &
Haapasalo (1990)
sottolinearono l'importanza della pervietà dei tubuli dentinali,
sostenendo che la presenza dello smear-layer impediva il passaggio di
medicamenti all'interno dei tubuli stessi e riduceva i conseguenti
effetti antibatterici. Allo stesso modo lo smear-layer fu
considerato ostacolo al buon adattamento del materiale da otturazione
alle pareti canalari (White
et al. 1984, Kennedy et al. 1986,
Gençoglu
et al. 1993) .
In alcuni studi (Yamada et al.
1983; Baumgartner & Mader 1987) fu sostenuta la tesi che
l'EDTA usato da solo non sarebbe stato in grado di rimuovere
completamente lo smear-layer. Molti autori hanno espresso opinioni
favorevoli all'utilizzo combinato di EDTA e di ipoclorito di sodio (in
quest’ordine). Goldman
et al. (1981) Yamada et al. (1983) dichiararono
che la maggiore efficacia nella rimozione dello smear-layer si otteneva
con l’uso contemporaneo di EDTA e di ipoclorito di sodio. Questo
effetto è probabilmente dovuto al fatto che l'azione di dissoluzione
delle sostanze organiche prodotta dall'ipoclorito di sodio è maggiore
dopo che l'EDTA ha demineralizzato la parte inorganica dello
smear-layer, ed ha lasciato esposta quella organica. Anche Bystrom & Sundqvist
(1985)
consigliarono un uso alternato degli irriganti in funzione di una
maggiore azione antibatterica. Favorevoli all’uso combinato di
NaOCl ed EDTA anche Baumgartner
& Mader (1987). Berutti et al.
(1997) consigliarono l’uso associato di EDTA al 10%, di un
tensioattivo e di ipoclorito di sodio al 5%, ritenendo questa
associazione ottimale per la disinfezione dei tubuli dentinali: il
tensioattivo che doveva essere utilizzato dopo l'EDTA aveva la funzione
di facilitare la penetrazione dell'ipoclorito di sodio nei tubuli
dentinali; la concentrazione dell’EDTA fu stabilita al 10% per ovviare
all’azione dell'ipoclorito di sodio, capace di modificare in parte il
titolo dell'EDTA portandolo al 4,5%; questo titolo fu considerato
ideale per un'azione efficace ma non eccessivamente demineralizzante
delle pareti canalari, che avrebbe potuto essere invece determinata da
concentrazioni maggiori.
Brännström
et al. (1974) osservarono che impiegando una
soluzione di benzalconio cloruro e di EDTA allo 0,2% si otteneva
una detersione accettabile delle superfici canalari , ma che soltanto
lo strato più superficiale dello smear-layer veniva rimosso, mentre gli
smear-plugs erano ancora presenti a livello dei tubuli dentinali. Goldman et al.
(1982) e Yamada et al. (1983) osservarono che
l'irrigazione in successione con EDTA al 17% e di NaOCl, al
termine della strumentazione, era in grado di rimuovere completamente
lo smear-layer. Baumgartner
et al. (1984) indicarono nell’acido citrico
l’agente chimico che, utilizzato durante la strumentazione, da solo od
in combinazione con l'ipoclorito di sodio, era maggiormente efficace
rispetto all'uso del solo ipoclorito di sodio nel rimuovere lo
smear-layer.
Baumgartner
& Mader (1987) tuttavia successivamente riportarono che la
maggiore efficacia si aveva invece con l'uso alternato, durante la
strumentazione canalare, di ipoclorito di sodio al 5,25% ed EDTA al
15%: risultava una perfetta pulizia del canale radicolare con assenza
di detriti organici ed inorganici, in presenza di tubuli dentinali
aperti. Garberoglio
et al. (1994) presero in considerazione
concentrazioni di EDTA al 3%: a tali concentrazioni l'EDTA
presentava nella rimozione del fango dentinale la stessa efficacia
dell'acido fosforico o dell'acido citrico al 17%, senza peraltro
produrre quella accentuata demineralizzazione della dentina e dei
tubuli dentinali che si poteva osservare dopo l'uso dell'acido
fosforico o citrico al 17%. Liolos et al.
(1997) osservarono che l'EDTA al 15%, usato come lavaggio finale al termine
della strumentazione, aveva la medesima efficacia dell'EDTA al 3% nella
rimozione dello smear-layer, mentre l’acido citrico al 50% dava luogo
ad una azione insoddisfacente.
O'Connell
et al. (2000) valutarono concentrazioni al 15%
di di sodio EDTA (PH 7.1; aggiustato con ipoclorito di sodio), al 15%
di tetrasodio EDTA (PH 7.1; aggiustato con acido cloridrico) e al 25%
di tetrasodio EDTA (PH 7.1; aggiustato con acido cloridrico): tutte le
soluzioni in combinazione con ipoclorito di sodio permisero una
rimozione completa dello smear-layer a livello del terzo coronale e
medio, mentre a livello del terzo apicale furono meno efficaci e fu
osservato un sottile strato residuo di smear-layer.
Gutierrez
et al. (1990) ottennero migliore rimozione
dello smear layer irrigando con acqua distillata ed effettuando un
lavaggio finale con EDTA al 17%, piuttosto che irrigando con NaOCl ed H2O2
per poi effettuare lavaggio finale con EDTA al 17% ed NaOCl al termine
della strumentazione: gli autori ipotizzarono che lo smear layer che si
formava sotto irrigazione con acqua distillata avesse una struttura
meno compatta e fosse più friabile di quello che si formava utilizzando
NaOCl.
Relativamente al tempo di applicazione necessario perché l’EDTA produca
un’azione efficace si trovano pareri differenti. Goldberg & Spielberg
(1982) riportarono che il tempo di permanenza ideale dell'EDTA
era di circa 15 minuti. Yamada et al. (1983), invece,
sostennero che pochi secondi fossero sufficienti. Meryon et al.
(1987) dimostrarono che lo smear-layer era completamente
rimosso dall'EDTA al 10% in un minuto, e che ne conseguiva un
incremento del diametro degli imbocchi tubularie. Anche Cergneux et al. (1987)
ottennero risultati simili dopo applicazione di EDTA al 15% per 4
minuti.
Altri lavori hanno esaminato gli effetti dell'EDTA sulla struttura
dentinale. Kennedy
et al. (1986) suggerirono che dalla rimozione dello
smear-layer impiegando REDTA (EDTA 17%, Cetrimide per ridurre la
tensione superficiale,acqua e idrossido di sodio) potesse risultare più
evidente apertura dei tubuli dentinali nei denti più "giovani",
che in quelli più "vecchi" caratterizzati da tratti di dentina
maggiormente sclerotica del terzo medio ed apicale. Baumgartner & Mader
(1987) riferirono che l'uso combinato di EDTA e di ipoclorito di
sodio aveva causato una progressiva dissoluzione di dentina
peritubulare ed intertubulare. Anche Cergneux et al.
(1987) e
Garberoglio
& Becce (1994) sottolinearono gli effetti erosivi
dell'EDTA. Çalt et
al. (2002) indagarono gli effetti tempo dipendenti dell'EDTA
sulla struttura dentinale, osservando il risultato dell'azione di 10 ml
di EDTA al 17% dopo uno e dieci minuti di applicazione (ed effettuando
poi una irrigazione con 10 ml di ipoclorito di sodio: già dopo un
minuto si otteneva la rimozione completa dello smear-layer, mentre dopo
dieci minuti di applicazionesi verificava una eccessiva erosione della
struttura intertubulare e peritubulare.
|
|
|

|
|
|
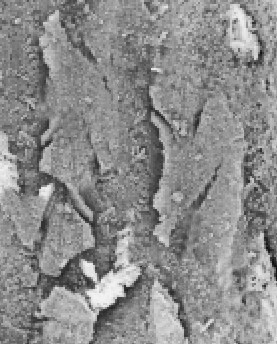
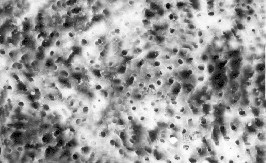
Parete dentinale dopo
strumentazione
e irrigazione con soluzione
fisiologica
|
Parete dentinale dopo
strumentazione
e irrigazione con
NaOCl 5.25%
|
Parete dentinale dopo
strumentazione,
irrigazione con NaOCl
5.25% ed EDTA 17%
|
COMPOSTI DELL'AMMONIO
QUATERNARIO
Sio
tratta di detergenti cationici capaci di ridurre la tensione
superficiale, con blando potere antibatterico (inattivato da presenza
di proteine), quasi nullo potere solvente. Sono in parte n parte
tossici ed irritanti.
AMINOQUINALDINIUM
DIACETATO
Si tratta di un composto
simile ai derivati dell'ammonio quaternario, surfactante, antibatterico
ad ampio spettro (non inibito da presenza di proteine), che dissolve la
matrice organica della dentina e in misura minore la matrice
inorganica, dotato di citotossicità lieve, con pH neutro (Kaufman et
al. 1978). Una versione commerciale è il Salvizol (Ravens,
Konstanz, Germany), aminoquinaldinumdiacetato al 5% a pH 6.6.
|
Kaufman
et al. (1978) confrontarono l'EDTAC (EDTA +
Cetavlon/formula Nygaard-Östby) e il Salvizol; il Salvizol fornì
risultati soddisfacenti di pulizia del canale, dissolse la matrice
organica della dentina, a differenza di EDTAC non alterò la dimensione
e la forma dei tubuli, dimostrò maggior potere pulente rispetto
all'EDTAC, e fu in grado di evidenziare il fronte di demineralizzazione
della dentina.
Spångberg
et al. (1978) Esaminarono il Salvizol allo 0,6%
(aminoquinaldinium diacetato), l’EDTAC (EDTA + Cetavlon/formula
Nygaard-Östby) e l’IKI (Ioduro di potassio iodato) al 2%, valutandone
tossicità (su cellule L dopo 4 ore di contatto) e potere irritante
(effetto su permeabilità capillare dopo iniezione intra-dermica); il
Salvizol dimostrò tossicità locale e potere irritante non superiore
allo Ioduro di potassio iodato; in soluzione acquosa dimostrò maggior
potere pulente rispetto all'EDTAC.
Koskinen
et al. (1980) immersero polpa bovina, che è
paragonabile alla polpa umana ma fornisce più tessuto
disponibile, a 37°C in varie soluzioni fra cui EDTAC, Salvizol
diacetato (allo 0.5% e allo 0.05%), NaOCl (allo 0.5%, 2.5% e 5%);
determinarono la quantità di tessuto dissolto attraverso il dosaggio
dell'idrossiprolina e del fosfato; determinarono il residuo insolubile
attraverso il dosaggio dell'idrossiprolina e del peso del residuo
secco; l'NaOCl al 2,5% e al 5% fu di gran lunga il piu efficace come
solvente, mentre impiegato allo 0,5% produsse azione molto scarsa; il
Salvizol diacetato allo 0,5% a allo 0,05% dimostrò scarsa azione.
|
SOSTANZE IODATE
L'azione è antisettica. Non
possiedeono azione proteolitica.
|
Spangberg
et al. (1973) dichiararono che erano soprattutto desiderabili irriganti
ad azione proteolitica, in grado di facilitare la sagomatura a la
detersione dei canali radicolari, e che gli antisettici iodofori e i
derivati basici dell'ammonio quaternario erano tossici ed irritanti, e
si sarebbe dovuto evitarne l'impiego.
|
SOLUZIONI
ANTIBIOTICHE
|
Senia
et al. (1971) dichiararono che gli antibiotici inducono reazioni
allergiche, tossiche, carcinogenetiche, e non andavano utilizzati come
irriganti canalari.
|
PROTOCOLLI
DI IRRIGAZIONE
I prodotti chimici usati per
pulire i canali infetti dovrebbero essere utilizzati in modo tale che
essi possano esprimere la loro piena potenzialità antibatterica,
piuttosto che inattivarsi reciprocamente. Quindi, se si impiega una
soluzione di ipoclorito durante la strumentazione, si dovrebbe evitare
che la sua efficacia venga ridotta dall'uso simultaneo di EDTA o acido
citrico. I canali dovrebbero rimanere sempre riempiti di ipoclorito del
sodio. Ciò aumenterà sia il tempo di contatto con l'irrigante che
l'efficacia di taglio degli strumenti (Yguel-Henry et al.
1990). Inoltre il carico di torsione sugli strumenti rotanti in
nichel-titanio diminuirà (Peters et al. 2005) se il canale è
riempito con fluidi piuttosto che mantenuto asciutto. E' stato
dibattuto il tema della corrosione degli strumenti come conseguenza del
contatto prolungato con l'ipoclorito (Kuphasuk et al. 2001).
Sommergere gli strumenti per ore in una soluzione di ipoclorito induce
corrosione (O’Hoy et al. 2003), e tuttavia non ci si deve
aspettare alcun effetto negativo come conseguenza dei brevi periodi di
contatto che si realizzano quando uno strumento viene utilizzato in un
canale radicolare pieno di ipoclorito (Haikel et al. 1998).
Dopo ogni strumento utilizzato, i canali dovrebbero essere irrigati
copiosamente con ipoclorito. Una volta che la sagomatura è completata,
i canali possono essere risciacquati abbondantemente con EDTA acquoso o
acido citrico. Non esistono indicazioni precise supportate da evidenza
scientifica circa i tempi da rispettare nella procedura (Hülsmann et
al. 2003). Ogni canale è risciacquato generalmente per almeno 1
minuto usando da 5 a 10 ml di soluzione chelante. Deve essere
sottolineato che l'esposizione prolungata forti chelanti come l'EDTA
può indebolire la dentina della radice (Calt & Serper 2002), dal
momento che durezza e modulo di elasticità della dentina variano
funzione del suo contenuto minerale (Angker et al. 2005).
Dopo la procedura di rimozione dello smear-layer, sembra utile
un'irrigazione finale con una soluzione antisettica (Yamada et al. 1983).
La scelta dell'irrigante finale dipende dal passaggio successivo del
trattamento, cioè dal fatto che si intenda o meno utilizzare una
medicazione intermedia. Se èprevisto l'uso di idrossido di calcio come
mediacazione intermedia, l'irrigazione finale dovrebbe essere
effettuata con ipoclorito del sodio, dal momento che questi due
prodotti chimici sono perfettamente complementari (Zehnder et al. 2003).
Sembra persino che mescolando la polvere di idrossido di calcio con la
soluzione irrigante di ipoclorito di sodio, piuttosto che con soluzione
fisiologica, si ottenga una medicazione intermedia più efficace
(Zehnder et al. 2003).
Se si ritiene che le pareti del canale siano state ripulite dai
detriti, e se l'intenzione è di effettuare l'otturazione canalare o di
utilizzare un gel di clorexidina come medicazione intermedia (Siqueira
& de Uzeda 1997), la dissoluzione necrotica del tessuto non
costituisce più il problema. In questi casi possono essere impiegati
prodotti chimici diversi dall'ipoclorito di sodio, e la clorexidina
sembra essere l'agente più promettente da usare come irrigante finale.
La clorexidina ha un'affinità per i tessuti dentali duri (Rölla et
al. 1970) e una volta legatasi ad una superficie, presenta
prolungata attività antimicrobica, un fenomeno denominato azione
residua (Rölla et al. 1971, Parsons et al. 1980).
L'azione residua non si osserva con l'ipoclorito di sodio (Dametto et
al. 2005).
In uno studio clinico randomizzato, una soluzione di clorexidina al 2%,
usata come un irrigante finale, ridusse significativamente la carica
batterica in canali radicolari che erano stati irrigati con ipoclorito
di sodio durante la preparazione canalare (Zamany et al. 2003).
Tuttavia, l'irrigazione finale con clorexidina fu confrontata con una
irrigazione finale con soluzione salina sterile, e quindi rimane non
chiarito se questa scelta sia preferibile al tradizionale lavaggio
finale con ipoclorito. Altri studi clinici hanno segnalato un effetto
positivo dell'infiltrazione del sistema canalare con ioduro del
potassio per 5-10 minuti, dopo preparazione chemiomeccanica (Peciuliene
et al. 2001, Kvist et al. 2004). Anche in questi
studi, tuttavia, non è stato usato l'ipoclorito nel gruppo controllo.
Ad ogni buon conto, una irrigazione finale con una soluzione di
clorexidina appare vantaggiosa, specialmente nei ritrattamenti, dove ci
si deve aspettare che nel sistema canalare si trovi un'alta percentuale
di batteri Gram+. Va tenuto presente che se è ancora presente
ipoclorito nel canale, la clorexidina eventualmente aggiunta
precipiterà in forma di massa rosso-brunastra. Quindi l'rrigazione con
clorexidina deve essere copiosa e prolungata, se si vuole ottenere una
efficace azione antibatterica e se si vuole evitare la discolorazione
del dente provocata dai precipitati menzionati. In alternativa, il
canale dovrebbe essere asciugato usando coni di carta assorbente, prima
del lavaggio finale con clorexidina.
ASPETTI
TECNICI DELL'IRRIGAZIONE CANALARE
La penetrazione di un irrigante nel sistema canalare è funzione del
diametro dell'ago rispetto alla dimensione della preparazione (Ram
1977). Quindi, pur mancando ancora evidenza scientifica, l'introduzione
di un ago sottile, con una punta di sicurezza, a lunghezza di lavoro o
a 1 millimetro di distanza da essa, rappresenta un approccio
interessante per migliorare l'efficacia dell'irrigazione nella zona
apicale infetta di denti non vitali con radiotrasparenza apicale.
Dovrebbe essere tenuto presente che durante l'irrigazione la soluzione
non procede apicalmente oltre 1 millimetro rispetto alla punta. Quindi
la dimensione apicale della preparazione diviene il parametro da
considerare (McGurkin-Smith et al. 2005). Se si usa un ago di
calibro 30, la preparazione apicale dovrebbe essere corrispondente a
misure ISO 35-40 se si vuole assicurare irrigazione adeguata all'area
apicale.
CONCETTI ALTERNATIVI
Quanto detto precedentemente
fornisce una sintesi di alcuni protocolli semplici e di alcuni
irriganti commercialmente disponibili per la detersione chimica del
sistema canalare. Ciò non significa che non ci possano essere altre
possibilità biologicamente accettabili per detrgere e decontaminare il
sistema canalare. Tuttavia, va sottolineato che negli studi iniziali i
nuovi concetti sono solitamente sovrastimati quando vengono confrontati
con gli standards di riferimento. (Alderson et al. 2004,
Torabinejad et al. 2003, Kaufman 1981). Alcuni metodi recenti
per migliorare la detrsione dei canali includono l'uso della luce laser
per indurre fotosensibilizzazione mortale sulla popolazione microbica
del canale (Kimura et al. 2000), l'irrigazione con l'acqua
elettrochimicamente attivata (Solovyeva & Dummer 2000) e
l'infiltrazione di ozono nel sistema endodontico (Deltour et al.
1970). Tuttavia, in termini di efficacia antibatterica nei confronti
dei microrganismi contenuti nei biofilms, vi è evidenza che nessuno di
questi metodi può rivaleggiare con una semplice irrigazione con
ipoclorito di sodio (Seal et al. 2002, Gulabivala et
al. 2004, Hems 2005).
Un'atra idea che continua a ritornare è la nozione che ridurre la
tensione superficiale aggiungendo agenti tensioattivi migliorerebbe
l'efficacia dei irriganti, poichè essi penetrerebbero meglio nei tubuli
dentinali e nei canali accessori (Abou-Rass & Patonai 1982, Tasman et
al. 2000). Nello studio originale che mostrava una migliore
penetrazione dei liquidi con tensione superficiale ridotta nei sistemi
canalari di molari estratti, non è stato precisato se questi denti
erano asciutti o erano stati mantenuti in un ambiente umido (Abou-Rass
& Patonai 1982). I canali radicolari e la dentina delle pareti
adiacenti in situ sono pieni di liquidi (Papa et al. 1994) e la
tensione superficiale dei liquidi introdotti svolge così un ruolo
secondario in questa situazione. L'infiltrazione della dentina da parte
di sostanze chimiche in soluzione acquosa si verifica tramite
diffusione piuttosto che attraverso scambio diretto di liquidi (Fish
1932). Di conseguenza, non può essere motivo di sorpresa constatare che
la riduzione della tensione superficiale degli irriganti non influenza
la loro capacità di rimuovere lo smear-layer (Zehnder et al.
2005), né aumenta la loro efficacia antibatterica nel canale radicolare
(Baker et al. 2004). Inoltre, ridurre la tensione superficiale
delle soluzioni usate durante la strumentazione può realmente causare
una penetrazione aumentata di detriti nei tubuli dentinali (Aktener et
al. 1989). Finalmente,, dovrebbe essere considerato che i concetti
concernenti l'irrigazione presentati qui sono finalizzati ad ottenere
un sistema canalare pulito idealmente preparato per la tecnica di
otturazione classica, che impiega guttaperca e un cemento endodontico.
In avvenire, potranno essere messe a punto altre modalità di
otturazione canalare, quali uso di sistemi resinosi adesivi (Shipper et
al. 2004), di materiali bioattivi (Zehnder et al. 2004), o
la rigenerazione del tessuto pulpare nei casi necrotici (Banchs &
Trope 2004). Anche se non è probabile che si abbiano cambiamenti
radicali nei concetti relativi all'irrigazione, l'importanza specifica
degli irriganti in queste procedure alternative deve ancora essere
definita.
LE
MEDICAZIONI CANALARI
L'impiego di medicazioni
intermedie, da collocare all'interno della camera pulpare o dei canali
radicolari fra un appuntamento e l'altro per mantenere od ottenere la
disinfezione dello spazio preparato, è stato nel passato da alcuni
sostenuto e da altri sconsigliato.
Come medicazioni intracanalari
sono stati usati antibiotici, formocresolo, formaideide, ioduro di
potassio iodato al 2%, metacresilacetato, paramonoclorofenolo
canforato, eugenolo, idrossido di calcio, pasta iodoformica.
|
Maddox et al. (1977)
dichiararono che nessun medicamento intermedio era meglio di un
batuffolo di cotone asciutto e sterile per prevenire il dolore tra gli
appuntamenti.
Treanor & Goldman (1972) valutarono in vitro l'efficacia di eugenolo, formocresolo, metacresilacetato,
monoclorofenolo canforato; i medicamenti vaporizzavano, ma non in grado
tale da superare l'apice; il formocresolo era il piu efficace a 72 ore tra quelli esaminati; il metacresilacetato era il piu efficace a
48 ore, mentre a 72 ore 1'efficacia si riduceva; il monoclorofenolo
canforato, l'eugenolo e il ormocresolo erano piu attivi a 72 ore che a
48 ore; in nessun caso una medicazione sterilizzava completamente il
canale.
Spangberg et al. (1973) suggerirono che in casi in cui
strumentazione a irrigazione non eliminavano l'infezione dal canale si
usasse ioduro di potassio iodato a concentrazione inferiore al 2%,
dieci volte quella germicida.
|
Per la maggior parte, le
medicazioni canalari sono meno impiegate rispetto al passato.
Si è risvegliato interessse
per i composti fenolici, per l'attività battericida che pare siano in
grado di esercitare nei confronti dell'Enterococcus Faecalis ((Stevens
& Grossman 1983, Haapasalo & Ørstavik 1987, Siqueira et al.
1996)).
L'idrossido di calcio
rimane invece ancora largamente studiato, e impiegato.
IDROSSIDO DI CALCIO
|
L'idrossido di calcio
è una sostanza alcalina forte, che si presenta in forma di polvere
bianca inodore e che mescolata con H2O produce una
sospensione con pH di circa 12.5.
L'idrossido di calcio ha formula Ca(OH)2 e corrisponde alla "calce spenta". L'ossido di calcio
ha invece formula CaO e corrisponde alla "calce viva", che reagendo con
l'acqua produce idrossido di calcio:
CaO + H2O = Ca(OH)2
La reazione è esotermica e può diventare esplosiva, ma è anche
espansiva e porta ad un aumento di volume da 2.8 (CaO leggero) a 6 (CaO
pesante) volte la massa iniziale. Questo effetto è quello su cui si
basa la terapia endo-ocalessica, usata nel passato. Esistono preparati
commerciali per uso endodontico contenenti ossido di calcio, ai quali
sono aggiunti ritardanti, quali il glicole etilenico e il glicole
propilenico, per evitare una troppo rapida sottrazione di H2O ai tessuti.
Secondo Tronstad et al. (Tronstad et al. 1981) la
capacità terapeutica del Ca(OH)2 dipende dalla disponibilità di OH- liberi: ciò
implica la necessità dell’azione veicolante di una soluzione. In
soluzione acquosa, l'idrossido di calcio si dissocia iioni calcio e
ioni
idrossido, ed è soprrattuto a questi ultimi che si devono gli effetti
potenzialmente utili che alla sostanza sono ascritti (Tronstad et
al. 1981):
• arresta il riassorbimento infiammatorio
• stimola la guarigione ossea
• ha effetto battericida
• denatura proteine endocanalari
• ioni Ca++ intervengono nelle reazioni immunitarie
• ioni Ca++ attivano reazioni ATPasi dipendenti (si
forma tessuto duro)
Va notato che
lo strato superficiale dell'idrossido di calcio a contatto
con la CO2 presente nell'aria si trasforma in CaCO3
insolubile.
Gli impieghi clinici
che dell'idrossido di calcio nel tempo sono stati suggeriti sono
molteplici:
1) incappucciamento indiretto
2) incappucciamento diretto
3) medicazione canalare
4) riempimento a lungo termine
5) essudazione nel canale
6) apecificazione, apicogenesi, perforazione radicolare
7) riassorbimenti
8) fratture orizzontali (giacenti nell'osso)
9) perforazioni iatrogene (nel contesto osseo)
PRODOTTI A BASE DI IDROSSIDO DI CALCIO
1) Paste indurenti
Contengono sostanze come il solfato di bario e la metilcellulosa, che
ne riducono l'efficacia
2) Liners
Sospensioni di Ca(OH)2 e ZnP04
+ polvere di resine e cellulosa in veicolo liquido volatile
3) Paste acquose non indurenti
Ca(OH)2 + soluzione fisiologica o H2O distillata o soluzione anestetica
|
IDROSSIDO
DI CALCIO COME MEDICAZIONE CANALARE
L'introduzione
in odontoiatria dell'idrossido di calcio si deve ad Hermann (Hermann
1920, Hermann 1930), sebbene storicamente il primo a consigliarne
l'uso per il trattamento della cosiddetta "fistula dentalis" sia stato
Nygren (Nygren 1838), mentre Codman (1851) fu il primo a impiegare
l'idrossido di calcio per tentare di conservare la polpa dentale
compromessa. Come riportato da Cvek (1989), l'idrossido di calcio ha
conosciuto crescente diffusione intorno al 1930 grazie al lavoro
pionieristico di Hermann (Teuscher & Zander 1938, Zander 1939).
Le prime segnalazioni di guarigioni pulpari ottenute grazie all'impiego
dell'idrossido di calcio sono comparse in letteratura fra il 1934 e il
1941. Da allora, e principalmente dopo la seconda guerra mondiale, le
indicazioni cliniche per il suo uso si sono via via estese, e questa
sostanza chimica si è affermata, con il passare del tempo sempre più
concordemente, come il miglior medicamento per indurre formazione di
tessuto duro e per favorire la guarigione dei tessuti pulpari e
periapicali vitali (Garcia 1983).
Anche se il meccanismo d'azione dell'idrossido di calcio non è stato
ancora completamente chiarito, sono stati pubblicati molti studi
scientifici sui i suoi effetti biologici, e sulla loro dipendenza dalla
liberazione di ioni Ca++ e OH- che si verifica
per dissociazione della sostanza. Nel corso del tempo sono stati
studiati il suo pH elevato e l'attività ionica che interviene nei
processi di guarigione, la diffusione attraverso i tubuli dentinali, la
sua influenza sulla microinfiltrazione apicale, ed alcuni temi clinici
quali il suo posizionamento all'interno del canale radicolare ela
gestione dei flareups, l'importanza della sostituzione periodica delle
medicazioni e dell'otturazione provvisoria.
Con l'uso clinico via via più diffuso dell'idrossido di calcio, la
letteratura ha preso a considerare le caratteristiche delle varie
formulazioni disponibili ed ha anche suggerito la miscelazione della
polvere di idrossido di calcio con altre sostanze, allo scopo di
migliorarne l'azione antibatterica, la radiopacità, il flusso e la
consistenza.
Varie proprietà biologiche
sono state attribuite a questa sostanza, quali attività antimicrobica
(Byström et al. 1985), capacità di dissolvere i tessuti
(Hasselgren et al. 1988, Andersen et al. 1992), inibizione del
riassorbimento dentale (Tronstad 1988), e capacità di indurre
riparazione per formazione di tessuto duro (Foreman & Barnes 1990).
In ragione di questi effetti, è stato suggerito l'uso dell' idrossido
di calcio in numerose situazioni cliniche (Heithersay 1975, Fava 1991).
Questa sostanza chimica è riconosciuta come una delle preparazioni
antimicrobiche più efficaci da impiegare nei canali radicolari
(Siqueira & Lopes 1999).
Come detto, la totale eliminazione dei batteri all'interno del sistema
canalare è difficile da ottenere
(Byström & Sundqvist 1981, Byström & Sundqvist 1985, Siqueira et
al. 1997). Le medicazioni intracanalari possono contribuire ad
eliminare i batteri sopravvissuti (Byström & Sundqvist 1985), e
l'idrossido di calcio è la sostanza per medicazione intracanalare che
in endodonzia è stata più utilizzata e studiata (Fava & Saunders
1999).
Le medicazioni possono essere preparate al momento miscelando polvere
di idrossido di calcio con soluzione salina, ma sono anche disponibili
molti preparati commerciali registrati, che sono stati testati sia
sugli animali che sugli esseri umani.
I meccanismi dell'attività
antimicrobica
La maggior parte dei batteri patogeni che si trovano nei canali
radicolari non può sopravvivere in ambiente fortemente alcalino
(Heithersay 1975). Poiché il pH dell'idrossido di calcio è circa 12.5,
parecchie specie batteriche che comunemente si trovano in canali
infettti sono eliminate dopo un breve periodo di contatto con questa
sostanza (Byström et al. 1985).
L'attività antimicrobica dell'idrossido di calcio è dovuta al rilascio
degli ioni idrossido in ambiente acquoso. Gli ioni idrossido sono
radicali liberi altamente ossidanti che mostrano estrema reattività,
nei confronti di numerose biomolecole (Freeman & Crapo 1982).
Questa reattività è alta ed indiscriminata, ma questi radicali liberi
diffondono raramente a distanza dalla sede in cui sono stati generati.
I loro effetti biocidi sulle cellule batteriche sono probabilmente
dovuti a tre meccanismi.
Il primo meccanismo consiste nel danneggiamento della membrana
citoplasmatica batterica. La membrana citoplasmatica batterica è sede
di funzioni importanti per la sopravvivenza della cellula, quali (a)
permeabilità e trasporto selettivo di soluti; (b) trasporto degli
elettroni e fosforilazione ossidativa nella specie aerobiche; (c)
escrezione degli esoenzimi idrolitici; (d) alloggiamento di enzimi e
molecole carriers che intervengono nella biosintesi del DNA, dei
polimeri della parete cellulare e dei lipidi della membrana; (e)
alloggiamento di recettori e altre proteine dei sistemi chemiotattici e
di altri sistemi di transduzione sensoriale (Brooks ed altri. 1998).
Gli ioni idrossido inducono la perossidazione dei lipidi, con
conseguente distruzione dei fosfolipidi, componenti strutturali della
membrana cellulare. Gli ioni idrossidoinoltre rimuovono gli atomi di
idrogeno dagli acidi grassi insaturi, generando un radicale lipidico
libero. Questo radicale lipidico libero reagisce con l'ossigeno, con
conseguente formazione di un perossido radicale lipidico, che rimuove
un altro atomo dell'idrogeno da un secondo acido grasso, generandoe un
altro perossido lipidico. Quindi i perossidi di per se' stessi agiscono
come radicali liberi, iniziando una reazione autocatalitica a catena,
con conseguente ulteriore perdita di acidi grassi insatui ed esteso
danno di membrana (Halliwell 1987, Cotran et al. 1999).
Il secondo meccanismo corrisponde alla denaturazione proteica. Il
metabolismo cellulare è altamente dipendente dalle attività
enzimatiche, e gli enzimi hanno attività e stabilità ottimali in una
gamma ristretta di pH, intorno alla neutralità. L'alcalinizzazione
fornita dall'idrossido di calcio induce la rottura dei legami ionici
che mantengono la struttura terziaria delle proteine. Di conseguenza,
l'enzima mantiene la sua struttura covalente, ma la catena
polipeptidica viene modificata a caso con configurazioni spaziali
risultanti variabili ed irregolari. Questi cambiamenti provocano
frequentemente la perdita di attività biologica dell'enzima e disturbo
del metabolismo cellulare (Voet & Voet 1995). Anche le proteine
strutturali possono essere danneggiate dagli ioni idrossido.
Il terzo meccanismo corrisponde al danneggiamento del DNA. Gli ioni
idrossido reagiscono con il DNA batterico ed provocaano interruzione
delle catene. Come conseguenza, alcuni geni vengono perduti (Imlay
& Linn 1988), la replica del DNA è inibita e l'attività cellulare è
disorganizzata. I radicali liberi possono anche indurre mutazioni
mortali per la cellula batterica. Vi è prova scientifica che tutti e
tre i meccanismi possono determinarsi (Halliwell 1987, Imlay & Linn
1988, Cotran et al. 1999). E' però difficile stabilire quale è
il meccanismo principale o il primo in ordine cronologico che determina
la morte delle cellule batteriche dopo esposizione ad una base forte. È
stato suggerito che la capacità dell'idrossido di calcio di assorbire
l'anidride carbonica può contribuire alla sua attività antibatterica
(Kontakiotis et al. 1995). Tuttavia, il cemento è permeabile ad
acqua, ioni e piccole molecole (Huang et al. 1992, Siqueira 1997).
Quindi, ai batteri rimasti nel sistema canalare, l'anidride carbonica
può essere fornita dall'esterno. In più, i batteri situati nelle
ramificazioni hanno accesso diretto all'anidride carbonica attraverso i
tessuti periradicolari. Non vi è quindi ragione di pensare che
l'idrossido di calcio impedisca il rifornimento di anidride carbonica
ai batteri.
La Disinfezione del canale
radicolare
Parecchi studi hanno dimostrato che l'idrossido di calcio ha effetto
letale sulle cellule batteriche
(Byström et al. 1985, Stuart et al. 1991, Georgopoulou
et al. 1993). Questi effetti sono stati osservati solo in
presenza di contatto diretto della sostanza con i batteri in soluzione.
In questa situazione, la concentrazione di ioni idrossido è molto alta,
e raggiunge livelli incompatibili per la sopravvivenza batterica. In
situazione clinica questo contatto non è sempre possibile. Studi nei
quali è stata impiegata la diffusione in agar hanno dimostrato che
l'idrossido di calcio combinato con una sostanza inerte (acqua
distillata, soluzione fisiologica o glicerina) non inibisce la crescita
di molti tra i batteri anaerobi obbligati e facoltativi (Difiore et
al. 1983, Siqueira & Gonçalves 1996, Abdulkader et al.
1996, Siqueira et al. 1996 Siqueira & Uzeda 1997, Siqueira et
al. 1997). Questo probabilmente è dovuto al fatto che i terreni di
coltura contegono sostanze tampone. Per cui, sebbene l'idrossido di
calcio possa diffondere attraverso il terreno, i livelli di pH
raggiunti attorno ad esso non sarebbero sufficienti a determinare
attività inibitoria (Siqueira & Gonçalves 1996). Le basi dei
metalli alcalini, quali NaOH e KOH, mostrano alta solubilità e quindi
possono diffondersi più dell'idrossido di calcio attraverso il terreno
di coltura. Ma se è vero che sia NaOH che KOH posseggono alto potere
antibatterico (Siqueira et al. 1996), è altrettanto vero che
l'alta solubilità e diffusibilità aumenta gli effetti citotossici di
queste sostanze sulle cellule ospiti. A causa dell'alta citotossicità,
queste sostanze non sono indicate per essere usate nella pratica
endodontica.
Anche se gli ioni idrossido possiedono effetti antibatterici, sono
richiesti valori piuttosto elevati di pH per distruggere i
microorganismi. L'uccisione dei batteri ad opera dell'idrossido di
calcio dipende dal fatto che vi sia un grande numero di di ioni
idrossido disponibili nella soluzione, e questo di solito succede
vicino a dove è applicata la pasta. anche detto che quando l'idrossido
di calcio diffonde nei tessuti, la concentrazione degli ioni idrossido
è diminuita come conseguenza dell'azione dei sistemi tampone
(bicarbonato e fosfato), degli acidi, delle proteine e dell'anidride
carbonica, per cui la relativa efficacia antibatterica può essere
ridotta o annullata (Siqueira et al. 1998, Siqueira & Uzeda
1998).
I tubuli dentinali possono costituire un serbatoio importante di
batteri, e dai tubuli l'infezione o la reinfezione del canale può
verificarsi durante e dopo il trattamento endodontico (Oguntebi 1994).
Occasionalmente questi batteri residui possono causare un'infezione
persistente, che compromette il risultato della terapia endodontica. I
batteri localizzati all'interno dei tubuli dentinali sono al riparo
dagli effetti delle difese cellulari e molecolari dell'ospite, dagli
antibiotici somministrati per via sistemica e dalla preparazione
chemiomeccanica. Di conseguenza, strategie di trattamento che siano
dirette all'eliminazione dell'infezione dei tubuli sono necessarie, e
devono avvalersi dell'impiego di medicamenti che capaci di penetrare
nei tubuli dentinali e di uccidere i batteri.
Affinchè l'idrossido di calcio agisca efficacemente come medicazione
intracanalare, gli ioni idrossido devono potersi diffondere attraverso
la dentina ed i resti del tessuto pulpare. Alcuni studi hanno
dimostrato che la diffusione attraverso la dentina è possibile.
|
Tronstad
et al. (1981) segnalarono che dopo 4 settimane di permanenza di una
medicazione a base di idrossido di calcio all'interno del canale, il pH
della dentina nella scimmia si innalzava; tuttavia, nelle zone più
distanti dal lume del canale i valori del pH aumentavano in minor
misura; nel canale radicolare, il pH era più maggiore di 12.2; la
dentina circostante, in contatto diretto con l'idrossido di calcio,
mostrava un pH di 8 - 11; e nella dentina più periferica, il pH variava
da 7.4 a 9.6.
Nerwich et al. (1993) investigarono nel corso di 4 settimane i
cambiamenti di pH dopo introduzione di una medicazione a base di
idrossido di calcio; apicalmente, il pH della dentina raggiunse un
livello di circa 9.5 dopo 2 settimane; nella dentina più esterna,
sebbene il pH iniziasse a salire più precocemente, il valore massimo
raggiunto fu basso, appena 9 dopo 2 settimane; il pH della dentina
interna cervicale raggiunse un picco a 10.8 dopo 24 ore e si stabilizzò
appena sopra 10; il pH della dentina cervicale più esterna raggiunse il
valore di 9 dopo 2 settimane
|
Questi risultati rivelano che una medicazione di idrossido di calcio
dopo una settimana alza il valore del pH della dentina più interna a
circa 9.0. In determinate circostanze, questi valori di pH in dentina
possono permettere la sopravvivenza o lo sviluppo di alcune specie
batteriche. I batteri variano nelle tolleranza al pH, e la maggior
parte di essi si moltiplica senza problemi a pH 6-9 (Padan et al. 1981).
Alcuni varietà di Escherichia Coli, Proteus Vulgaris, Enterobacter
Aerogenes e Pseudomonas Aeruginosa possono sopravvivere a pH 8 o 9
(Atlas 1997). Queste specie batteriche sono state isolate
occasionalmente da canali radicolari infetti, e causano solitamente
infezioni secondarie (Haapasalo et al. 1983, Tronstad 1992,
Siren et al. 1997). Alcuni Enterococchi tollerano valori molto
elevati di pH, da 9 a 11. Anche i funghi generalmente esibiscono una
larga tolleranza a valori pH diversi, e si sviluppano pH 5-9 (Atlas
1997). Varietà di Prevotella Intermedia, Fusobacterium Nucleatum and
Porphyromonas Gingivalis possono avere sviluppo stabile a pH alcalino,
approssimativamente a valori di 8.0-8.3 (Marsh et al. 1993).
Il pH dell'ambiente rappresenta una condizione selettiva drastica, e
soltanto i microrganismi che sono in grado di adattarsi possono
proliferare. La maggior parte delle proteine e delle altre molecole
biologicamente importanti mantengono la loro attività/stabilità
ottimali in un range ristretto di valori di pH, attorno alla neutralità.
La tolleranza batterica ai cambiamenti del pH può dipendere
dall'attivazione di pompe protoniche specifiche, di sistemi enzimatici
specifici e/o di dispositivi tampone, che contribuiscono a mantenere
praticamente costante il pH interno (Padan et al. 1981). Oltre
che questi meccanismi, alcuni prodotti batterici generati durante la
crescita possono aiutare i batteri a neutralizzare il pH. Parecchi
studi hanno attestato l'inefficacia dell'idrossido di calcio
nell'eliminazione delle cellule batteriche all'interno dei tubuli
dentinali.
|
Haapasalo
& Ørstavik (1987) riportarono che una pasta all'idrossido di calcio
non fu in grado di eliminare l'Enterococcus Faecalis dai tubuli
dentinali, nemmeno da quelli superficiali. Safavi et al. (1990)
dimostrarono che l'Enterococcus Faecium rimaneva vitale nei tubuli
dentinali dopo periodi relativamente lunghi di trattamento con
idrossido di calcio/soluzione salina.
Ørstavik & Haapasalo (1990) osservarono che l'idrossido di calcio
impiegava 10 giorni per disinfettare i tubuli dentinali infettati da
batteri anaerobi facoltativi
Heling et al. (1992) trovarono che l'idrossido di calcio non
mostrava alcuna attività antibatterica contro l'Enterococcus Faecalis
all'interno dei tubuli dentinali, e che non era efficace nella
sterilizzazione della dentina o nel prevenire una infezione secondaria.
Siqueira & Uzeda (1996) dimostrarono che l'idrossido di calcio
associato con soluzione fisiologica era inefficace, anche dopo 1
settimana dil contatto, nell'eliminazione dell'Enterococcus Faecalis e
del Fusobacterium Nucleatum presenti all'interno dei tubuli dentinali.
|
Per essere efficaci contro i batteri posizionati all'interno dei tubuli
dentinali, gli ioni idrossido dell'idrossido di calcio dovrebbero
diffondersi nella dentine a concentrazioni sufficienti. È stato
segnalato che la dentina ha capacità tampone in quanto sono presenti
donatori di protoni, come
H2PO4-, H2CO3, e HCO3-, nello strato idratato dell'idrossiapatite, che
forniscono protoni addizionali e mantengono il pH inalterato (Wang
& Hume 1988, Nerwich et al. 1993).
Di conseguenza, per avere effetti antibatterici all'interno dei tubuli
dentinali, la diffusione ionica dell'idrossido di calcio dovrebbe
soverchiare la capacità tampone della dentina, raggiungendo livelli di
pH sufficienti a distruggere i batteri. Quando l'idrossido di calcio è
impiegato per breve periodo di tempo, i microrganismi probabilmente
sono esposti a livelli mortali di ioni idrossido soltanto in
corrispondenza dell'orifizio dei tubuli.
Un altro elemento da considerare è la disposizione delle cellule
batteriche che colonizzano le pareti del canale, poiché i batteri
situati alla periferia delle colonie possono proteggere dal contatto
con l'idrossido di calcio quelli situati più profondamente, all'interno
dei tubuli. Anche i batteri che colonizzano il tessuto necrotico nelle
ramificazioni, negli istmi e nelle irregolarità sono probabilmente
protetti dall'azione dell'idrossido di calcio. Di conseguenza una
medicazione di breve durata con idrossido di calcio sembra poter
eliminare pricipalmente le cellule batteriche in contatto diretto con
questa sostanza, come i batteri situati nel canale principale o negli
strati superficiali interni della dentina. Queste zone sono anche
quelle più comunemente influenzate dalle procedure chemiomeccaniche.
La capacità di un medicamento di dissolversi e diffondere nel sistema
canalare sembrerebbe essenziale per un'azione efficace (Ørstavik 1997).
Una sospensione acquosa satura di idrossido di calcio possiede un pH
elevato, che ha un grande potenziale citotossico. Tuttavia, questa
sostanza deve la sua biocompatibilità alla bassa solubilità e alla
scarsa diffusibilità in acqua, che limitano
la citotossicità alla zona del tessuto in contatto diretto con
l'idrossido di calcio. D'altro canto, la bassa solubilità e la bassa
diffusibilità dell'idrossido di calcio rendono difficile che si
verifichi un aumento veloce e significativo del pH capace di eliminare
i batteri posizionati all'interno dei tubuli dentinali e indovati nelle
complessità anatomiche. Inoltre, la capacità tampone dei tessuti
controlla le variazioni del pH.
A causa di questi fattori, l'idrossido di calcio è un antisettico ad
azione lenta, solo l'esposizione prolungata può consentire la
saturazione dei residui tissutali e della dentina e, teoricamente, solo
l'esposizione prolungata all'idrossido di calcio può consentire di
ottenere un sistema canalare privo di batteri. Tuttavia, l'uso
sistematico di una medicazione intracanalare prolungata non sembra
poter essere accettabile nell'endodonzia moderna.
D'altra parte il tempo necessario affinchè l'idrossido di calcio
disinfetti efficacemente il sistema canalare è ancora sconosciuto. Gli
studi clinici condotti seguendo protocolli di campionamento dei canali
radicolari hanno fornito risultati contraddittori.
|
Cvek et
al. (1976) rilevarono che il 90% dei campioni prelevati di canali
radicolari 3 mesi dopo medicazione con idrossido di calcio/soluzione di
Ringer non davano luogo a crescita microbica. Byström et al.
(1985) dimostrarono che l'idrossido di calcio eliminava efficacemente
tutti i microrganismi quando la medicazione era mantenuta per 4
settimane.
Reit & Dáhlen (1988) rilevarono che l'infezione persisteva nel 26%
dei canali dopo 2 settimane di medicazione con idrossido di calcio.
Sjögren et al. (1991) ) segnalarono che una medicazione
intracanalare con idrossido di calcio per 1 settimana eliminava
efficacemente i batteri nel canale radicolare nel 100% dei casi.
Ørstavik et al. (1991) rilevarono la persistenza di batteri
nel 34.4 % dei canali radicolari dopo una settimana di medicazione con
idrossido di calcio. Barbosa et al. (1997) segnalarono che 12
di 45 casi (26.7%) medicati con idrossido di calcio per 1 settimana
fornivano colture positive.
|
E'stato dimostrato che canali
con colture in partenza negative possono presentare successivamente
risultato positivo (Sjögren 1996, Sjögren et al. 1997). Ciò
accade perché i microorganismi possono essere presenti nel sistema
canalare, ma possono contemporaneamente sfuggire alla rilevazione nei
campioni che sono stati prelevati. I motivi possono essere molteplici,
e uno di questi è che i batteri situati in istmi, tubuli dentinali e
ramificazioni possono essere inaccessibili alla campionatura del canale
principale. In più, sia lo smear-layer che i residui di idrossido di
calcio sulle pareti canalari possono limitare fisicamente l'accesso ai
batteri durante le procedure di campionamento. Un altro motivo è che,
poiché la coltura ha la sensibilità per rilevare approssimativamente 103-104
cellule in un campione (Zambon & Haraszthy 1995), è possibile che
al momento del prelievo fosse presente nel canale un numero di batteri
insufficiente a consentire il rilievo con questo metodo.
Anche se gli Enterococchi non sono normalmente presenti o sono presenti
in numero molto basso nei casi non trattati (Byström et al. 1985,
Sundqvist et al. 1998), gli studi disponibili suggeriscono che
sono agenti importanti nel fallimento endodontico.
|
Molander
et al. (1998) esaminarono la condizione
microbiologica in 100 denti con radici otturate associate a lesioni
periradicolari. Gli anaerobi facoltativi predominavano fra i batteri
isolati, e corrispondevano al 69% delle specie identificate. Gli
Enterococchi furono trovati nel 32% dei denti studiati. Nelle stesse
condizioni, Möller (1966) e Sundqvist et al. (1998) isolarono
l'Enterococcus Faecalis nel 29% al 38%, rispettivamente, dei canali in
cui si evidenziò presenza di microrganismi. E' un dato acquisito che la
medicazione con idrossido di calcio è inefficace contro gli
Enterococchi (Stevens & Grossman 1983, Byström et al. 1985,
Haapasalo & Ørstavik 1987, Siqueira & Uzeda 1996). Di
conseguenza, il frequente isolamento degli Enterococchi mette in
discussione l'uso sistematico dell'idrossido di calcio come medicazione
intracanalare (Molander et al. 1998).
|
I batteri possono sopravvivere, nonostante la medicazione
intracanalare, per parecchi motivi. Il primo è che le specie batteriche
presenti nel canale radicolare possono essere intrinsecamente
resistenti al medicamento. Il secondo è che le cellule batteriche
possono essere indovate all'interno di complessità anatomiche e quindi
essere inaccessibili per il medicamento. Il terzo è che la medicazione
può essere neutralizzata da componenti tissutali e da cellule o
prodotti batterici, e quindi perdere il suo potere antibatterico. Il
quarto è che le medicazioni possono rimanere nel sistema canalare per
un tempo insufficiente per raggiungere e uccidere le cellule
batteriche. Infine, i batteri possono alterare la loro struttura genica
dopo cambiamenti delle condizioni nel canale, e queste modificazioni
possono permettere loro di sopravvivere anche in ambiente sfavorevole.
Buoni risultati clinici sono stati ottenuti con l'uso come medicamento
intracanalare dell'idrossido di calcio (Heithersay 1975, Tronstad
1992). Ciò nonostante, l'attività antibatterica dell'idrossido di
calcio è ancora tema di discussione, e non è chiaro se i benefici
effetti di questa sostanza possano essere considerati soltanto
conseguenza di essa (Seltzer 1988).
L'influenza del veicolo
sull'attività antimicrobica
Numerose sostanze sono state usate come veicoli per l'idrossido di
calcio. I veicoli hanno differente solubilità in acqua e idealmente non
dovrebbero cambiare significativamente il pH dell'idrossido di calcio.
La maggior parte delle sostanze usate come veicolo non hanno attività
antibatterica significativa. Si possono citare l'acqua distillata, la
soluzione salina e la glicerina. Altre sostanze, quali il
paramonoclorofenolo canforato (CMCP) e il metacresilacetato, sono
invece battericide. Frank (1966) suggeriva di mescolare idrossido di
calcio con CMCP nelle procedure di apecificazione. Alcuni autori hanno
criticato il suggerimento, considerando inutile di aggiungere
all'idrossido di calcio agenti antimicrobici, e particolarmente agenti
che si sono dimostrati irritanti per i tessuti (Cvek et al. 1976,
Anthony et al. 1982). Recentemente, l'associazione idrossido di
calcio/CMCP ha suscitato rinnovato interesse a causa dell'inefficienza
relativa dell'idrossido di calcio nei confronti di alcuni
microorganismi, tra i quali l'Enterococcus Faecalis. Anche se ilCMCP ha
in vitro effetti antibatterici pronunciati sui batteri anaerobi (Ohara et
al. 1993, Siqueira et al. 1996), molti studi hanno
riscontrato che l'idrossido di calcio è superiore al CMCP nei confronti
di questa categoria di microrganismi (Byström et al. 1985,
Stuart et al. 1991, Georgopoulou et al. 1993).
Tuttavia, il CMCP è stato riconosciuto più efficace rispetto
all'idrossido di calcio nei confronti dell'Enterococcus Faecalis
(Stevens & Grossman 1983, Haapasalo & Ørstavik 1987, Siqueira et
al. 1996).
Come descritto precedentemente, gli effetti dell'idrossido di calcio
sono fortemente dipendenti dalla disponibilità di ioni idrossido in
soluzione. I terreni di coltura, i liquidi intercellulari e la dentina
contengono sostanze tampone che possono impedire l'attività
dell'idrossido di calcio causando una diminuzione del pH. Siqueira
& Uzeda (1996) verificarono che la combinazione di idrossido di
calcio e soluzione salina era inefficaci nell'eliminazione
dell'Enterococcus Faecalis e del Fusobacterium Nucleatum dai tubuli
dentinali, anche dopo 1 settimana di esposizione. Invece, la
combinazione di idrossido di calcio/CMCP/glicerina uccideva i batteri
nei tubuli dopo esposizione di un'ora, tranne l'Enterococcus Faecalis
che richiedeva un giorno di esposizione.
Gli studi in cui sono furono usate prove di diffusione in agar
rivelarono che l'associazione idrossido di calcio/CMCP aveva
pronunciata attività contro i batteri facoltativi ed anaerobi,
superiore a quella dimostrata da combinazioni di idrossido di calcio e
sostanze inerti (Difiore et al. 1983, Siqueira et al. 1996,
1997b, Siqueira & Uzeda 1997).
Siqueira & Uzeda (1998) valutarono l'influenza di tre veicoli
differenti sull'attività antibatterica dell'idrossido di calcio nei
confronti di quattro specie comunemente presenti nelle infezioni
endodontiche; usarono una modificazione del metodo della diluizione del
brodo di coltura; l'associazione idrossido di calcio/CMCP/glicerina
uccise velocemente i batteri. Questi risultati indicano che il CMCP
aumenta l'efficacia antibatterica delle medicazioni a base di idrossido
di calcio. Altre associazioni di idrossido di calcio uccidono
ugualmente i batteri , ma richiedono più tempo. Derivati fenolici,
quale CMCP, fenolo canforato, timolo ed eugenolo, sono stati usati
estesamente in odontoiatria per molti anni. I composti fenolici
possiedono forti proprietà antibatteriche e l'alogenazione intensifica
la loro attività antimicrobica. Il fenolo pare possa danneggiare le
membrane batteriche contenenti lipidi, con conseguente perdita di
contenuto cellulare. Ad alte concentrazioni, i fenoli provocano
precipitazione delle proteine citoplasmatiche cellulari (O'Connor &
Rubino 1991). A concentrazioni più basse, i composti fenolici
inattivano i sistemi enzimatici essenziali e possono anche causare lisi
della parete delle cellule batteriche (Hugo & Russel 1998). Alcune
proprietà dei composti fenolici, quale tensione superficiale bassa
(Naumovich 1963) e solubilità nei lipidi (O'Connor & Rubino 1991)
conferiscono alle medicazioni alta penetrabilità e diffusibilità.
Quindi, la miscela idrossido di calcio/CMCP possiede ampio spettro di
azione, ed elimina i batteri situati a distanza dall'area in cui si
trova la medicazione (Siqueira 1997).
Alencar et al. (1997) determinarono la presenza di MCP in
associazioni di idrossido di calcio/MCP usate come medicazioni
endocanalari nei cani per 2, 4, 7 e 14 giorni; rilevarono una perdita
di circa il 50% di MCP nella medicazione dopo 48 ore, senza ulteriore
perdita significativa dopo periodi più lunghi.
Questi risultati indicano che gli effetti del MCP possono persistere
nel canale radicolare per almeno 14 giorni. Le infezioni endodontiche
sono polimicrobiche, e non esiste alcun medicamento efficace contro
tutti i batteri presenti in canali radicolari infetti. Una combinazione
di due medicamenti può produrre effetti cumulativi o sinergici.
L'evidenza suggerisce che l'associazione di idrossido di calcio e CMCP
ha più largo spettro antibatterico, più ampio raggio di azione
antibatterica ed uccide i batteri più velocemente delle miscele di
idrossido di calcio con veicoli inerti. Di conseguenza, il CMCP non può
essere considerato un veicolo per l'idrossido di calcio, ma un
medicamento supplementare.
Sebbene il CMCP abbia forte attività citotossica (Spangberg et al.
1979), la letteratura riporta risposte tissutali favorevoli alle
associazioni idrossido di calcio/CMCP (Torneck et al. 1973,
Holland et al. 1979). Questa associazione deve probabilmente
la sua biocompatibilità a tre fattori.
Il primo fattore è la bassa concentrazione di paramonoclorofenolo (MCP)
liberato. L'associazione idrossido di calcio/CMCP fornisce
paramonoclorofenolato di calcio, un sale debole che libera
progressivamente il MCP e gli ioni idrossido nel mezzo circostante
(Anthony et al. 1982). È ben noto che una sostanza può avere
effetti benefici o deleteri, a seconda della relativa concentrazione.
Il rilascio dalla medicazione di piccole quantità di MCP potrebbe
essere insufficiente a produrre effetti citotossici. Il secondo fattore
è l'effetto denaturante dell'idrossido di calcio sul tessuto
connettivo, che può impedire la penetrazione del MCP nei tessuti,
riducendone la tossicità (Siqueira 1997). Il terzo fattore dipende
probabilmente dall'effetto antimicrobico della medicazione, che
permette il verificarsi di una guarigione naturale senza irritazione
infettiva persistente. Se la zona della ferita non è colonizzata da
batteri quando si determina l'irritazione chimica transitoria, non c'è
motivo di credere che non si verifichi riparazione del tessuto non
appena l'irritazione chimica iniziale diminuisce di intensità.
Poiché il MCP è liberato in quantità sufficiente per esercitare
eccellente attività antibatterica, e poiché il MCP non possiede
tossicità selettiva nei confronti dei microrganismi, è abbastanza
verosimile che la seconda e/o terza ipotesi siano corrette.
il Significato della barriera fisica
L'impiego delle medicazioni intracanalari è stato suggerito, oltre che
per eliminare i batteri rimasti all'interno del sistema canalare dopo
la preparazione chemomiomeccanica, anche per altri motivi. Le
medicazioni intracanalari dovrebbero anche rappresentare una barriera
fisico-chimica, in grado di impedire la proliferazione dei
microorganismi residui e la reinfezione del canale da parte di batteri
provenienti dalla cavità orale (Siqueira 1997). Le medicazioni
intracanalari possono impedire la penetrazione nel canale dei batteri
contenuti nella saliva fondamentalmente in due modi.
In primo luogo, i medicamenti che possiedono proprietà antibatteriche
possono rappresentare una barriera chimica contro l'infiltrazione
uccidendo i batteri, quindi impedendo il loro ingresso nel canale
radicolare. Il sistema canalare può essere ricontaminato solo quando il
numero di cellule batteriche è tale da soverchiare l'attività
antibatterica del medicamento. Va considerato però che la saliva
diluisce il medicamento, e può neutralizzarne gli effetti, permettendo
l'invasione dei microorganismi.
In secondo luogo, i medicamenti che riempiono interamente il canale
agiscono come barriera fisica contro la penetrazione batterica. La
ricontaminazione del canale avverrà soltanto per solubilizzazione del
medicamento da parte della saliva, per permeabilità del medicamento
alla saliva, e per percolazione di saliva all'interfaccia fra il
medicamento e le pareti del canale radicolare. Tuttavia, considerando
tutti i meccanismi, se il medicamento ha anche effetti antibatterici,
la neutralizzazione deve verificarsi prima dell'invasione batterica.
Siqueira et al. (1998) valutarono la capacità in vitro che
alcuni medicamenti hanno di impedire la ricontaminazione completa da
parte dei batteri della saliva di canali non sigillati coronalmente;
canali medicati con palline di cotone impregnate con CMCP vennero
ricontaminati completamente in media in 6.9 giorni; canali riempiti con
idrossido di calcio/soluzione salina e idrossido di calcio
CMCP/glicerina mostrarono completa ricontaminazione in media,
rispettivamente, in 14.7 e 16.5 giorni; le medicazioni a base di
idrossido di calcio erano sensibilmente più efficaci rispetto al CMCP
nell'impedire la ricontaminazione del canale radicolare ad opera dei
batteri contenuti nella saliva.
La capacità dei preparati a base di idrossido di calcio di fornire
effettivo riempimento riempimento del canale è probabilmente più
importante nel ritardare la ricontaminazione rispetto all'effetto
chimico. L'idrossido di calcio ha bassa solubilità in acqua, ed è
quindi dissolto lentamente anche in saliva, per cui rimane nel canale
per un lungo periodo, ritardando la progressione batterica verso il
foramen apicale.
Indipendentemente dal veicolo utilizzato, l'idrossido di calcio sembra
rappresentare una barriera fisica efficace. Medicamenti che all'interno
del canale fungono da barriera fisica possono uccidere i microorganismi
residui riducendo e isolando i substrati per lo sviluppo dei batteri, e
limitando lo spazio per la loro moltiplicazione (Dahlén & Möller
1992, Siqueira et al. 1998). Certamente questa può essere una
delle azioni antimicrobiche possibili dell'idrossido di calcio.
Conclusioni
L'idrossido di calcio ha un ruolo importante in endodonzia, e il suo
impiego è indicato in numerose circostanze cliniche (Foreman &
Barnes 1990). L'idrossido di calcio ha un limitato spettro d'azione
antibatterica, e non risulta efficace su tutti i microrganismi
potenzialmente presenti all'interno dei canali infetti. In aggiunta, le
proprietà fisico-chimiche di questa sostanza possono limitare la sua
efficacia nella disinfezione dell'intero sistema canalare, soprattutto
quando l'impiego è di breve durata. Ulteriori ricerche scientifiche
sono necessarie per chiarire l'effettiva sua efficacia antimicrobica e
i relativi meccanismi di azione all'interno del sistema canalare, come
pure l'effetto di associazioni con altri medicamenti.
REFERENCES
Abdulkader
A, Duguid R, Saunders EM. The antimicrobial activity of endodontic
sealers to anaerobic bacteria. Int Endod J 1996; 29: 280-3.
Abou-Rass
M, Franck AL, Glick DH. The anticurvature filing method to prepare the
curved root canals. J Am Dent Assoc 1981; 101: 792-4.
Abou-Rass M, Oglesby SW. The effects of temperature, concentration, and
tissue type on the solvent ability of sodium hypochlorite. J Endod
1981; 7:376-7.
Abou-Rass M, Patonai FJ, Jr. The effects of decreasing surface tension
on the flow of irrigating solutions in narrow root canals. Oral Surg
Oral Med Oral Pathol 1982; 53: 524-6.
Addy M, Moran JM. Clinical indications for the use of chemical adjuncts
to plaque control: chlorhexidine formulations. Periodontol 2000 1997;
15: 52-4.
Ahmad M, Pitt Ford TR, Crum LA. Ultrasonic debridement of root canals:
an insight into the mechanisms involved. J Endod 1987; 13: 93-101.
Akpata ES, Blechman H. Bacterial invasion of pulpal dentin wall in
vitro. J Dent Res 1982; 61: 435-8.
Aktener BO, Cengiz T, Piskin B. The penetration of smear material into
dentinal tubules during instrumentation with surface-active reagents: a
scanning electron microscopic study. J Endod 1989; 15: 588-90.
Alderson P, Green S, Higgins J. Cochrane Reviewer’s Handbook. The
Cochrane Library, Chichester: John Wiley & Sons, Ltd., 2004.
Alencar AHG, Leonardo MR, Bezerra Silva LA, Silva RS, Ito IY.
Determination of the p-monochlorophenol residue in the calcium
hydroxide+p-monochlorophenol combination used as an intracanal dressing
in pulpless teeth of dogs with induced chronic periapical lesion. J
Endod 1997; 23: 522-4.
Angker
L, Swain MV, Kilpatrick N. Characterising the micro-mechanical
behaviour of the carious dentine of primary teeth using
nano-indentation. J Biomech 2005; 38: 1535-42.
Andersen M, Lund A, Andreasen JO, Andreasen FM. In vitro solubility of
human pulp tissue in calcium hydroxide and sodium hypochlorite. Endod
Dent Traumatol 1992; 8: 104-8.
Anthony
DR, Gordon TM, del Rio CE. The effect of three vehicles on the pH of
calcium hydroxide. Oral Surg Oral Med Oral Pathol 1982; 54: 560-5.
Armitage
GC, Ryder MI, Wilcox SE. Cemental changes in teeth with heavily
infected root canals. J Endod 1983; 9: 127-30.
Atlas RM. Principles of Microbiology, 2nd edn. Dubuque, IA: WCB
Publishers,1997.
Attin T, Buchalla W, Zirkel C, Lussi A. Clinical evaluation of the
cleansing properties of the noninstrumental technique for cleaning root
canals. Int Endod J 2002; 35: 929–33.
Austin JH, Taylor HD. Behavior of hypochlorite and of chloramine-T
solutions in contact with necrotic and normal tissue in vivo. J Exp Med
1918; 27: 627-33.
Austin JH, Taylor HD. Behaviour of hypochlorite solution in contact
with necrotic and normal tissues in vivo. J Exp Med 1918; 27: 624-33.
Baker N, Eleazer P, Averbach R, Seltzer S. Scanning electron micros-
copy study of the efficacy of various irrigating solutions. J Endod
1975; 1: 127-35.
Baker NE, Liewehr FR, Buxton TB, Joyce AP. Antibacterial efficacy of
calcium hydroxide, iodine potassium iodide, betadine, and betadine
scrub with and without surfactant against E faecalis in vitro. Oral
Surg Oral Med Oral Pathol Oral Radiol Endod 2004; 98: 359-64.
Baldo BA, Fisher MM. Substituted ammonium ions as allergenic
determinants in drug allergy. Nature 1983; 306: 262-4.
Banchs F, Trope M. Revascularization of immature permanent teeth with
apical periodontitis: new treatment protocol? J Endod 2004; 30: 196-200.
Barbosa CA, Gonçalves RB, Siqueira JF, De Uzeda M. Evaluation of the
antibacterial activities of calcium hydroxide, chlorhexidine, and
camphorated paramonochlorophenol as intracanal medicament. A clinical
and laboratory study. J Endod 1997; 23: 297-300.
Barnett
F, Trope M, Khoja M, Tronstad L. Bacteriologic status of the root canal
after sonic, ultrasonic and hand instrumentation. Endod Dent Traumatol
1985; 1: 228-31.
Baumgartner JC, Brown CM, Mader CL, Peters DD, Shulman JD. A scanning
electron microscopic evaluation of root canal debridement using saline,
sodium hypochlorite, and citric acid. J Endod 1984; 10: 525-31.
Baumgartner JC, Cuenin PR. Efficacy of several concentrations of sodium
hypochlorite for root canal irrigation. J Endod 1992;18:605-12.
Baumgartner JC, Ibay AC. The chemical reactions of irrigants used for
root canal debridement. J Endod 1987; 13: 47-51.
Baumgartner JC, Mader CL. A scanning electron microscopic evaluation of
four root canal irrigation regimens. J Endod 1987; 13: 147-57.
Baumgartner JC, Mader CL. A scanning electronic microscopic evaluation
of four root canal irrigation regimen. J Endod 1987; 13: 147-57.
Bence R, Madonia JV, Weine FS, Smulson MH. A microbiologic evaluation
of endodontic instrumentation in pulpless teeth. Oral Surg Oral Med
Oral Pathol 1973: 35: 676-83
Bernstein JA, Stauder T, Bernstein DI, Bernstein IL. A combined
respiratory and cutaneous hypersensitivity syndrome induced by work
exposure to quaternary amines. J Allergy Clin Immunol 1994; 94: 257-9.
Berutti E, Marini R, Angeretti A. Penetration ability of different
irrigants into dentinal tubules. J Endod 1997; 23: 725-7.
Bloomfield SF, Miles GA. The antibacterial properties of sodium
dichloroisocyanurate and sodium hypochlorite formulations. J Appl
Bacteriol 1979; 46: 65-73.
Blum H. Hypochlorit und seine Anwendung in der zahnärztlichen Praxis.
Dtsch Zahnärztl Wschr 1921; 24: 21-4.
Brännström M, Nyborg H. Bacterial growth and pulpal changes under
inlays cemented with zinc phosphate and epoxylite CBA 9080. J Prosthet
Dent 1974; 31: 556-65.
Buttler TK, Crawford JJ. The detoxifying effect of varying
concentrations of sodium hypochlorite on endotoxins. J Endod 1982; 8:
59-66.
Bystrom A, Sundqvist G. Bacteriologic evaluation of the efficacy of
mechanical root canal instrumentation in endodontic therapy. Scand J
Dent Res 1981; 89: 321-8.
Bystrom
A, Sundqvist G. Bacteriologic evaluation of the effect of 0.5 percent
sodium hypochlorite in endodontic therapy. Oral Surg Oral Med Oral
Pathol 1983; 55: 307-12.
Byström A, Claesson R, Sundqvist G. The antibacterial effect of
camphorated paramonochlorophenol, camphorated phenol and calcium
hydroxide in the treatment of infected root canals. Endod Dent
Traumatol 1985; 1: 170-5.
Bystrom A, Sundqvist G. The antibacterial action of sodium hypochlorite
and EDTA in 60 cases of endodontic therapy. Int Endod J 1985;18: 35-40.
Caliskan MK, Turkun M, Alper S. Allergy to sodium hypochlorite during
root canal therapy: a case report. Int Endod J 1994; 27:1 63-7.
Calt S, Serper A. Time-dependent effects of EDTA on dentin structures.
J Endod 2002; 28: 17-9.
Calt S,Serper A. Time dependent effects of EDTA on dentin structures. J
.Endod . 2002; 28: 17-9.
Cergneux M, Ciucchi B, Dietschi JM, Holz J. The influence of the smear
layer on the sealing ability of canal obturation. Int Endod J 1987: 20:
228-32.
Chavez De Paz LE, Dahlén G, Molander A, Möller A, Bergenholtz G.
Bacteria recovered from teeth with apical periodontitis after
antimicrobial endodontic treatment. Int Endod J 2003; 36: 500-8.
Cheung GS, Stock CJ. In vitro cleaning ability of root canal irrigants
with and without endosonics. Int Endod J 1993; 26: 334-43.
Clark-Holke D, Drake D, Walton R, Rivera E, Guthmiller JM. Bacterial
penetration through canals of endodontically treated teeth in the
presence or absence of the smear layer. J Dent 2003; 31: 275-81.
Codman WW (1851) Ossification of the pulp of a tooth. Newsletter IV, 90
(printed in Malo PRT, Kessler Nieto F, Vadillo MVM. Hidroxido de calcio
y apicoformacioÂn. Revista EspanÄ ola de Endodoncia 1987; 5: 41-61.
Coons
D, Dankowski M, Diehl M, et al. Performance in detergents, cleaning
agents and personal care products: detergents. In: Falbe J, ed.
Surfactants in consumer products. Berlin: Springer-Verlag, 1987:
197-305.
Cotran RS, Kumar V, Collins T, eds. Robbins pathologic basis of
disease. 6th ed. Philadelphia, USA: W.B. Saunders, 1999.
Costerton
JW, Lewandowski Z, DeBeer D, Caldwell D, Korber D, James G. Biofilms,
the customized microniche. J Bacteriol 1994; 176: 2137-42.
Costigan SM. Effectiveness of hot hypochlorites of low alkalinity in
destroying Mycobacterium tuberculosis. J Bacteriol 1936; 32: 57-63.
Cotter JL, Fader RC, Lilley C, Herndon DN. Chemical parameters,
antimicrobial activities, and tissue toxicity of 0.1 and 0.5% sodium
hypochlorite solutions. Antimicrob Agents Chemother 1985; 28: 118-22.
Crane AB. A practical root canal technique. Philadelphia 1920, Lea
& Febiger Publishers, p 69.
Crane AB. A predictable root canal technique. Philadelphia: Lea &
Febiger, 1920.
Cunningham WT, Balekjian AY. Effect of temperature on
collagen-dissolving ability of sodium hypochlorite endodontic irrigant.
Oral Surg Oral Med Oral Pathol 1980; 49: 175-7.
Cunningham WT, Balekjian AY. Effect of temperature on
collagen-dissolving ability of sodium hypochlorite endodontic irrigant.
Oral Surg Oral Med Oral Pathol Endod 1980; 49: 175-7
Cunningham WT, Joseph SW. Effect of temperature on the bactericidal
action of sodium hypochlorite endodontic irrigant. Oral Surg Oral Med
Oral Pathol 1980; 50: 569-71.
Cvek M, Nord CE, Hollender L. Antimicrobial effect of root canal
debridement in teeth with immature root. A clinical and microbiologic
study. Odontol Revy 1976; 27: 1-10.
Cvek M, Hollender L, Nord CE. Treatment of non-vital permanent incisors
with calcium hydroxide. VI. A clinical, microbiological and
radiological evaluation of treatment in one sitting of teeth with
mature or immature root. Odontol Revy 1976; 27: 93-108.
Cvek
M. Calcium Hydroxide in the Treatment of Traumatized Teeth. Stockholm:
Eastman Institute, 1989.
Dahlén
G, Bergenholtz G. Endotoxic activity in teeth with necrotic pulps. J
Dent Res 1980;59:1033– 40.
Dahlén G, Möller AJR. Microbiology of endodontic infections. In: Slots
J, Taubman MA, eds. Contemporary Oral Microbiology and Immunology. St
Louis, USA: Mosby, 1992; 444-75.
Dahlén
G, Samuelsson W, Molander A, Reit C. Identification and antimicrobial
susceptibility of Enterococci isolated from the root canal. Oral
Microbiol Immunol 2000; 15: 309-12.
Dakin HD. On the use of certain antiseptic substances in the treatment
of infected wounds Brit Med J 1915; 2: 318-20.
Dametto FR, Ferraz CC, de Almeida Gomes BP, Zaia AA, Teixeira FB, de
Souza-Filho FJ. In vitro assessment of the immediate and prolonged
antimicrobial action of chlorhexidine gel as an endodontic irrigant
against Enterococcus faecalis. Oral Surg Oral Med Oral Pathol Oral
Radiol Endod 2005; 99: 768-72.
Davies GE, Francis J, Martin AR, Rose FL, Swain G.
1:6-Di-4’-chlorophenyldiguanidohexane (hibitane); laboratory
investigation of a new antibacterial agent of high potency. Br J
Pharmacol Chemother 1954; 9:192-6.
Deltour MM, Vincent J, Lartigau G. Effet lethal de l’ozone sur
certaines souches de bactéries aerobes dans un modèle de chambre
pulpaire. Rev Odontostomatol Midi Fr 1970; 15: 278-84.
Difiore
PM, Peters DD, Setterstrom JA, Lorton L.The antibacterial effects of
calcium hydroxide apexification pastes on Streptococcus sanguis. Oral
Surg Oral Med Oral Pathol 1983; 55; 91-4.
Dwyer TG, Torabinejad M. Radiographic and histologic evaluation of the
effect of endotoxin on the periapical tissues of the cat. J Endod 1980;
7: 31-5.
Dychdala GR. Chlorine and chlorine compounds. In: Block SS, ed.
Disinfection, sterilization and preservation. Philadelphia: Lea &
Febiger, 1991: 131-51.
Emilson CG. Susceptibility of various microorganisms to chlorhexidine.
Scand J Dent Res 1977; 85: 255-65.
Engström B. The significance of Enterococci in root canal treatment.
Odontol Revy 1964; 15: 87-106.
Evanov C, Liewehr F, Buxton TB, Joyce AP. Antibacterial efficacy of
calcium hydroxide and chlorhexidine gluconate irrigants at 37 degrees C
and 46 degrees C. J Endod 2004; 30: 653-7.
Fabricius L, Dahlén G, Holm SE, Möller ÅJR. Influence of combinations
of oral bacteria on periapical tissues of monkeys. Scand J Dent Res
1982; 90: 200–6.
Fava LRG. Pastas de hidroxido de calcio. Consideracoes sobre seu
emprego clinico em Endodontia. Rev Paul Odontol 1991; 13: 36-43
Fava LRG, Saunders WP. Calcium hydroxide pastes: classification and
clinical indications. Int Endod J 1999; 32: 257-82.
Fish EW An experimental investigation of enamel, dentine and the dental
pulp. London: John Bale, 1932.
Foreman PC, Barnes F. A review of calcium hydroxide. Int Endod J 1990;
23: 283-97.
Foulkes
DM. Some toxicological observations on chlorhexidine. J Periodontal Res
Suppl 1973; 12: 55-60.
Frais S, Ng YL, Gulabivala K. Some factors affecting the concentration
of available chlorine in commercial sources of sodium hypochlorite. Int
Endod J 2001; 34: 206-15.
Frank AL. Therapy for the divergent pulpless tooth by continued apical
formation. J Am Dent Assoc 1966; 72: 87-93.
Freeman
BA, Crapo JD. Biology of disease, free radicals and tissue injury.
Lab.Invest 1982; 47: 412-26.
Garberoglio
R, Becce C. Smear layer removal by root canal irrigants. A comparative
scanning electron microscopic study. Oral Surg Oral Med Oral Pathol
1994; 78: 359-67.
Garcia GH. Bosquejo historico sobre Endodoncia. Revista EspanÄ ola de
Endodoncia 1983; 1: 123-33.
Gençoglu
N, Samani S, Günday M. Dentinal wall adaptation of thermoplasticized
gutta-percha in the absence or presence of smear layer: a scanning
electron microscopic study. J Endod 1993; 19: 558-62.
Georgopoulou M, Kontakiotis E, Nakou M. In vitro evaluation of the
effectiveness of calcium hydroxide and paramonochlorophenol on
anaerobic bacteria from the root canal. Endod Dent Traumatol 1993; 9:
249-53.
Girard
S, Paqué F, Badertscher M, Sener B, Zehnder M. Assessment of a gel-type
chelating preparation containing 1-hydroxyethylidene-1,
1-bisphosphonate. Int Endod J 2005; 38: 810-16.
Goldberg F, Spielberg C. The effect of EDTAC and the variation of its
working time analyzed with scanning electron microscopy. Oral Surg Oral
Med Oral Pathol 1982; 53: 74-7.
Goldman LB, Goldman M, Kronman JH, Lin PS. The efficacy of several
irrigating solutions for endodontics: a scanning electron microscopic
study. Oral Surg Oral Med Oral Pathol 1981; 52: 197-204.
Goldman M, Goldman LB, Cavalieri R, Bogis J, Lin PS. The efficacy of
several irrigating solutions for endodontics: a scanning electron
microscopic study. Part 2. J Endod 1982; 8: 487-92.
Gordon TM, Damato D, Chfistner P. Solvent effect of various dilutions
of sodium hypochlorite on vital and necrotic tissue. J Endod 1981; 7:
466-9.
Grahnén H, Krasse B. The effect of instrumentation and flushing of
nonvital teeth in endodontic therapy. A clinical and bacteriological
study. Odont Revy 1963; 14: 167-77.
Grahnén H, Krasse B. The effect of instrumentation and flushing of
non-vital teeth in endodontic therapy I. Odontol Revy 1962; 13: 167-77.
Grossman L I. Endodontic Practice, ed. 10, Philadelphia 1981, Lea and
Febiger, p 279.
Grossman L I. Endodontic Practice, ed. 7, Philadelphia 1970, Lea &
Febiger.
Grossman LI, Meiman B. Solution of pulp tissue by chemical agents. J Am
Dent Assoc 1941; 28: 223-5.
Grossman LI, Meiman BW. Solution of pulp tissue by chemical agents. J
Am Dent Assoc 1941; 28: 223-5.
Grossman LI. Irrigation of root canals. J Am Dent Assoc 1943; 30:
1915-7.
Gulabivala K, Stock CJ, Lewsey JD, Ghori S, Ng YL, Spratt DA.
Effectiveness of electrochemically activated water as an irrigant in an
infected tooth model. Int Endod J 2004; 37: 624-31.
Gutiérrez JH, Herrera VR, Berg EH, Villena F, Jofré A. The risk of
intentional dissolution of the smear layer after mechanical preparation
of root canals. Oral Surg Oral Med Oral Pathol 1990; 70: 96-108.
Gutierrez JH, Jofre A, Villena F. Scanning electron microscope study on
the action of endodontic irrigants on bacteria invading the dentinal
tubules. Oral Surg Oral Med Oral Pathol 1990; 69: 491-501.
Gutierrrez JH, Garcia J. Microscopic and macroscopic investigation on
results of mechanical preparation of root canals. Oral Surg Oral Med
Oral Pathol 1968; 25: 108-16.
Gwinnett AJ. Smear layer: morphological considerations. Oper Dent Suppl
1984; 3: 2-12.
Haapasalo M, Ørstavik D. In vitro infection and disinfection of
dentinal tubules. J Dent Res 1987; 66: 1375-9.
Haapasalo M, Ranta K, Ranta H. Facultatice Gram-negative enteric rods
in persistent periapical infections. Acta Odontol Scand 1983; 91:
458-63.
Haga CS. Microscope measurements of root canal preparations following
instrumentation. J Br Endod Soc 1968; 2: 41-6.
Hahn CL, Best AM, Tew JG. Cytokine induction by Streptococcus mutans
and pulpal pathogenesis. Infect Immun 2000; 68: 6785-9.
Haikel Y, Gorce F, Allemann C, Voegel JC. In vitro efficiency of
endodontic irrigation solutions on protein desorption. Int Endod J
1994; 27: 16-20.
Haikel Y, Serfaty R, Wilson P, Speisser JM, Allemann C. Cutting
efficiency of nickeltitanium endodontic instruments and the effect of
sodium hypochlorite treatment. J Endod 1998; 24: 736-9.
Hamp SE, Emilson CG. Some effects of chlorhexidine on the plaque flora
of the beagle dog. J Periodontal Res Suppl 1973; 12: 28-35.
Hand RE, Smith ML, Harrison JW. Analysis of the effect of dilution on
necrotic tissue dissolution property of sodium hypochlorite. J Endod
1978; 4: 60-8.
Haapasalo M, Ranta H, Ranta. Facultative gram-negative enteric rods in
persistent periapical infections. Acta Odontol Scand 1983; 41: 19-22.
Haapasalo
M, Ørstavik D. In vitro infection and disinfection of dentinal tubules.
J Dent Res 1987; 66: 1375-9.
Halliwell
B. Oxidants and human disease: some new concepts. FASEB J 1987; 1:
358-64.
Harrison
JW, Baumgartner JC, Zielke DR. Analysis of interappointment pain
associated with the combined use of endodontic irrigants and
medicaments. J Endod 1981; 7: 272-6.
Harrison JW. Irrigation of the root canal system. Dent Clin North Am
1984; 28: 797-808.
Hasselgren G, Olsson B, and Cvek M. Effects of calcium hydroxide and
sodium hypochlorite on the dissolution of necrotic porcine muscle
tissue. J Endod 1988; 14: 125-7.
Hata G, Hayami S, Weine F S, Toda T. Effectiveness of oxidative
potential water as a root canal irrigant. Int Endod J 2000; 34: 308-17.
Heithersay GS. Calcium hydroxide in the treatment of pulpless teeth
with associated pathologhy. J Brit Endo Soc 1975; 8: 74-93.
Heling
I, Steinberg D, Kenig S, Gavrilovich I, Sela MN, Friedman M. Efficacy
of a sustained-release device containing chlorhexidine and Ca(OH)2 in
preventing secondary infection of dentinal tubules. Int Endod J 1992;
25: 20- 4.
Heling
I, Rotstein I, Dinur T, Szwec-Levine Y, Steinberg D. Bactericidal and
cytotoxic effects of sodium hypochlorite and sodium
dichloroisocyanurate solutions in vitro. J Endod 2001; 27: 278–80.
Hems RS, Gulabivala K, Ng YL, Ready D, Spratt DA. An in vitro
evaluation of the ability of ozone to kill a strain of Enterococcus
faecalis. Int Endod J 2005; 38: 22-9.
Hennessey TS. Some antibacterial properties of chlorhexidine. J
Periodontal Res Suppl 1973; 12: 61-7.
Hermann
BW. Calcium hydroxyd als mitten zum behandeln und fuÈ llen von
WurzelkanaÈllen (dissertation). Wursburg, 1920: (printed in: Malo PRT,
Kessler Nieto F, Vadillo MVM. Hidroxido de calcio y apicoformacio Ân.
Revista EspanÄ ola de Endodoncia 1987; 5: 41-61).
Hermann
BW. Dentinobliteration der WuÈ rzelkanaÈlen nach Behandlung mit
Kalzium. Zahnarztliche Rundschau 1930; 21: 888-99.
Hermann
BW. Biologische Wurzelbehandlung. Frankfurt arn Main: W. Kramer, 1936.
Hess
W. Zur Anatomie der Wurzelkanäle des menschlichen gebisses mit
berücksichtigung der feinen Verzweigungen am foramen apicale. Schweiz
Vierteljahresschr Zahnheilk 1917; 1: 1-53.
Heuer MA. The biomechanics of endodontic therapy. Dent Clin North Am
1963; 7: 341-59.
Holland R, Souza V, Nery MJ, Mello W, Bernabe PFE, Otoboni. Filho JA.
A histological study of the effect of calcium hydroxide in the
treatment of pulpless teeth of dogs. J Brit Endo Soc 1979; 12: 15-23.
Hostynek
JJ, Patrick E, Younger B, Maibach HI. Hypochlorite sensitivity in
man.Contact Dermatitis 1989; 20: 32–7.
Huang T-JG, Schilder H, Nathanson D. Effects of moisture content and
endodontic treatment on some mechanical properties of human dentin. J
Endod 1992; 18: 209-15.
Hugo
WB, Russel AD. Pharmaceutical Microbiology, 6th edn. Oxford, UK:
Blackwell Science, 1998.
Hülsmann
M, Hahn W. Complications during root canal irrigation—literature review
and case reports. Int Endod J 2000; 33: 186-93.
Hülsmann M, Heckendorff M, Lennon A. Chelating agents in root canal
treatment: mode of action and indications for their use. Int Endod J
2003; 36: 810-30.
Imlay JA, Linn S. DNA damage and oxygen radical toxicity. Science.
1988; 240: 1302-09.
Ingle
JI, Zeldow BJ. An evaluation of mechanical instrumentation and the
negative culture in endodontic therapy. J Am Dent Assoc 1958; 57: 471-6.
Jacinto RC, Gomes BP, Shah HN, Ferraz CC, Zaia AA, Souza-Filho FJ.
Quantification of endotoxins in necrotic root canals from symptomatic
and asymptomatic teeth. J Med Microbiol 2005; 54: 777-83.
Jeansonne MJ, White RR. A comparison of 2.0% chlorhexidine gluconate
and 5.25% sodium hypochlorite as antimicrobial endodontic irrigants. J
Endod 1994; 20: 276-8.
Jensen SA, Walker TL, Hutter JW, Nicoll BK. Comparison of the cleaning
efficacy of passive sonic activation and passive ultrasonic activation
after hand instrumentation in molar root canals. J Endod 1999; 25:
735-8.
Kamburis JJ, Barker TH, Barfield RD, Eleazer PD. Removal of organic
debris from bovine dentin shavings. J Endod 2003; 29: 559–61.
Kaufman AY, Binderman I, Tal M, Gedalia I, Peretz G. New
chemoterapeutic agent for root canal treatment. Oral Surg Oral Med Oral
Pathol 1978; 46: 283-95.
Kaufman AY. Facial emphysema caused by hydrogen peroxide irrigation:
report of a case. J Endod 1981; 7: 470–2.
Kaufman AY. The use of dequalinium acetate as a disinfectant and
chemotherapeutic agent in endodontics. Oral Surg Oral Med Oral Pathol
1981; 51: 434–41.
Kennedy WA, Walker WA, Gough RW. Smear layer removal effects on apical
leakage. J Endod 1986; 12: 21-7.
Kerekes K, Tronstad L. Long-term results of endodontic treatment
performed with a standardized technique. J Endod 1979; 5: 83–90.
Kimura Y, Wilder-Smith P, Matsumoto K. Lasers in endodontics: a review.
Int Endod J 2000; 33 :173-85.
Kokkas AB, Boutsioukis A, Vassiliadis LP, Stavrianos CK. The influence
of the smear layer on dentinal tubule penetration depth by three
different root canal sealers: an in vitro study. J Endod 2004; 30: 1002.
Kontakiotis E, Nakou M, Georgopoulou M. In vitro study of the indirect
action of calcium hydroxide on the anaerobic flora of the root canal.
Int Endod J 1995; 28: 285-9.
Koskinen
KP, Meurman JH, Stenvall H. Appearance of chemically treated root canal
walls in the scanning electron microscope. Scand J Dent Res 1980; 88:
505-12.
Koskinen KP, Stenvall H, Vitto V. Dissolution of bovine pulp tissue by
endodontic solutions. Scand J Dent Res 1980: 88: 406-11.
Krautheim AB, Jermann TH, Bircher AJ. Chlorhexidine anaphylaxis: case
report and review of the literature. Contact Dermatitis 2004; 50: 113-6.
Krell KV, Johnson RJ. Irrigation patterns of ultrasonic endodontic
files. Part II. Diamond-coated files. J Endod 1988; 14: 535-7.
Kuphasuk C, Oshida Y, Andres CJ, Hovijitra ST, Barco MT, Brown DT.
Electrochemical corrosion of titanium and titanium-based alloys. J
Prosthet Dent 2001; 85: 195-202.
Kvist T, Molander A, Dahlén G, Reit C. Microbiological evaluation of
one- and two-visit endodontic treatment of teeth with apical
periodontitis: a randomized, clinical trial. J Endod 2004; 30: 572-6.
Lambjerg-Hansen H, Fiehn N-E, Krogh P. Endodontiske medikamenter.
Tandlaegebladet 1982; 86: 467-73.
Langeland K. Tissue response to dental caries. Endod Dent Traumatol
1987; 3: 149 -71.
Lester KS, Boyde A. Scanning electron microscopy of instrumented,
irrigated and filled root canals. Br Dent J 1977; 143: 359-67.
Lester KS, Boyde A. Scanning electron microscopy of instrumented,
irrigated and filled root canals. Br Dent J 1977; 143: 359-67.
Liolios E, Economides N, Parissis-Messimeris S, Boutsioukis A. The
effectiveness of three irrigating solutions on root canal cleaning
after hand and mechanical preparation. Int Endod J 1997; 30: 51-7.
Loel DA. Use of acid cleanser in endodontic therapy. J Am Dent Assoc
1975; 90: 148-51.
Love RM. Enterococcus faecalis—a mechanism for its role in endodontic
failure.Int Endod J 2001; 34: 399-405.
Lussi A, Nussbacher U, Grosrey J. A novel noninstrumented technique for
cleansing the root canal system. J Endod 1993; 19: 549-53.
Maddox DL, Walton RE, Davis CO. Incidence of posttreatment endodontic
pain related to medicaments and other factors. J Endod 1977; 3: 447-52.
Mader CL, Baumgartner JC, Peters DD. Scanning electron microscopic
investigation of the smeared layer on root canal walls. J Endod 1984;
10: 477-83.
Marsh PD, McKee AS, McDermid AS. Continuous culture study. In: Shah HN,
Mayrand D, Genco RJ, eds. Biology of the Species Porphyromonas
Gingivalis. Boca Raton, FL: CRC Press, 1993: 105-23.
Martin
H, Cunningham WT, Norris JP. A quantitative comparison of the ability
of diamond and K-type files to remove dentin. Oral Surg Oral Med Oral
Pathol 1980; 50: 566-8.
Martin H. Ultrasonic disinfection of the root canal. Oral Surg Oral Med
Oral Pathol 1976; 42:92–9.
Mayer BE, Peters OA, Barbakow F. Effects of rotary instruments and
ultrasonic irrigation on debris and smear layer scores: a scanning
electron microscopic study. Int Endod J 2002; 35: 582-9.
McComb D, Smith CD. A preliminary scanning electron microscopy study of
root canals after endodontic procedures. J Endod 1975; 1: 238-42.
McComb D, Smith DC, Beagrie GS. The results of in vivo endodontic
chemomechanical instrumentation-a scanning electron microscopic study.
J Br Endod Soc 1976; 9: 1-8.
McDonnell G, Russell AD. Antiseptics and disinfectants: activity,
action, and resistance. Clin Microbiol Rev 1999; 12: 147-79.
McGurkin-Smith R, Trope M, Caplan D, Sigurdsson A. Reduction of
intracanal bacteria using GT rotary instrumentation, 5.25% NaOCl, EDTA,
and Ca(OH)2. J Endod 2005; 31: 359-63.
Meryon SD, Tobias RS, Jakeman KJ. Smear removal agents: a quantitative
study in vivo and in vitro. J Prosthet Dent 1987; 20: 174-9.
Molander A, Reit C, Dahlén G, Kvist T. Microbiological status of
root-filled teeth with apical periodontitis. Int Endod J 1998; 31: 1-7.
Möller AJR. Microbiological examination of root canals and periapical
tissues of human teeth. Odontologisk Tidskrift 1966; 74: 1-380.
Moodnik
RM, Dorn SO, Feldman MJ, Levey M, Borden BG. Efficacy of biomechanical
instrumentation: a scanning electron microscopic study. J Endod 1976;
2: 261-6.
Moorer WR, Wesselink PR. Factors promoting the tissue dissolving
capability of sodium hypochlorite. Int Endod J 1982; 15: 187-96.
Morse DR. The endodontic culture technique: an impractical and
unnecessary procedure. Dent Clin N Am 1971; 15: 793-806.
Naenni N, Thoma K, Zehnder M. Soft tissue dissolution capacity of
currently used and potential endodontic irrigants. J Endod 2004; 30:
785-7.
Nair PN. Pathogenesis of apical periodontitis and the causes of
endodontic failures. Crit Rev Oral Biol Med 2004; 15: 348-81.
Naumovich DB. Surface tension and pH of drugs in root canal therapy.
Oral Surg Oral Med Oral Pathol 1963; 16: 965-8.
Nerwich
A, Figdor D, Messer HH. pH changes in root dentine over a 4-week period
following root canal dressing with calcium hydroxide. J Endod 1993; 19:
302-6.
Nicholls
E. Endodontics, 2nd ed, Bristol, Wright J & Sons, Ltd, 1977 p 138.
Nickel JC, Ruseska I, Wright JB, Costerton JW. Tobramycin resistance of
Pseudomonas aeruginosa cells growing as a biofilm on urinary catheter
material. Antimicrob Agents Chemother 1985; 27: 619-24.
Nyborg W. Acoustic streaming. In: Mason WP, ed. Physical acoustics. New
York: Academic Press, 1965: 265-383.
Nygaard Östby B. Chelation in root canal therapy. Odontol Tidskr 1957;
65: 3-11.
Nygren J (1838) Radgivare Angaende Basta Sattet Att Varda Ah Bevara
Tandernas Fuskhet, Osv. Stockholm.
O’Connell
MS, Morgan LA, Beeler WJ, Baumgartner JC. A comparative study of smear
layer removal using different salts of EDTA. J Endod 2000; 26: 739-43.
O'Connor DO, Rubino JR. Phenolic compounds. In: Block SS, ed.
Disinfection, Sterilization, and Preservation, 4th edn. Philadelphia,
USA: Lea & Febiger, 1991; 204-24.
Oguntebi
BR. Dentine tubule infection and endodontic therapy implications. Int
Endod J 1994; 27: 218-22.
Ohara
P, Torabinejad M, Kettering JD. Antibacterial effects of various
endodontic medicaments on selected anaerobic bacteria. J Endod 1993;
19: 498-500.O’Hoy PY, Messer HH, Palamara JE. The effect of cleaning
procedures on fracture properties and corrosion of NiTi files. Int
Endod J 2003; 36: 724-32.
Olgart L, Brännström M, Johnson G. Invasion of bacteria into dentinal
tubules. Experiments in vivo and in vitro. Acta Odontol Scand 1974; 32:
61-70.
Olgart LG. Bacteriological sampling from root canals directly after
chemome- chanical treatment: A clinical and bacteriological study. Acta
Odontol Scand 1969; 27: 91-103.
Orstavik D, Haapasalo M. Disinfection by endodontic irrigants and
dressings of experimentally infected dentinal tubules. Endod Dent
Traumatol 1990; 6: 142-9.
Ørstavik D, Haapasalo M. Disinfection by endodontic irrigants and
dressings of experimentally infected dentinal tubules. Endod Dent
Traumatol 1990; 6: 142-9.
Ørstavik D, Kerekes K, Molven O. Effects of extensive apical reaming
and calcium hydroxide dressing on bacterial infection during treatment
of apical periodontitis: a pilot study. Int Endod J 1991; 24; 1-7.
Ørstavik D. Intracanal medication. In: Pitt Ford TR, ed. Harty's
Endodontics in Clinical Practice, 4th edn. Oxford, UK: Wright, 1997:
106-22.
Ørstavik D, Qvist V, Stoltze K. A multivariate analysis of the outcome
of endodontic treatment. Eur J Oral Sci 2004; 112: 224-30.
Ørstavik D. Time-course and risk analyses of the development and
healing of chronic apical periodontitis in man. Int Endod J 1996; 29:
150-5.
Padan E, Zilberstein D, Schuldiner S. pH homeostasis in bacteria.
Biochim. Biophys Acta 1981; 650: 151-66.
Papa
J, Cain C, Messer HH. Moisture content of vital vs endodontically
treated teeth. Endod Dent Traumatol 1994; 10: 91-3.
Parsons GJ, Patterson SS, Miller CH, Katz S, Kafrawy AH, Newton CW.
Uptake and release of chlorhexidine by bovine pulp and dentin specimens
and their subsequent acquisition of antibacterial properties. Oral Surg
Oral Med Oral Pathol 1980; 49: 455-9.
Patterson SS. In vivo and in vitro studies of the effect of the
disodium salt of ethylenediamine tetra-acetate on human dentine and its
endodontic implications. Oral Surg Oral Med Oral Pathol 1963; 16:
83-103.
Peciuliene V, Reynaud AH, Balciuniene I, Haapasalo M. Isolation of
yeasts and enteric bacteria in root-filled teeth with chronic apical
periodontitis. Int Endod J 2001; 34: 429-34.
Penick EC, Osetek EN. Intracanal drugs and chemicals in endodontic
therapy. Dent Clin North Am 1970; 14: 743-52.
Peters LB, Van Winkelhoff AJ, Buijs JF, Wesselink PR. Effects of
instrumentation, irrigation and dressing with calcium hydroxide on
infection in pulpless teeth with periapical bone lesions. Int Endod J
2002; 35: 13-21.
Peters LB, Wesselink PR. Periapical healing of endodontically treated
teeth in one and two visits obturated in the presence or absence of
detectable microorganisms. Int Endod J 2002; 35: 660-7.
Peters OA, Boessler C, Zehnder M. Effect of liquid and paste-type
lubricants on torque values during simulated rotary root canal
instrumentation. Int Endod J 2005; 38: 223-9.
Peters OA. Current challenges and concepts in the preparation of root
canal systems: a review. J Endod 2004; 30: 559-67.
Petersson K, Soderstrom C, Kiani-Anaraki M, Levy G. Evaluation of the
ability of thermal and electrical tests to register pulp vitality.
Endod Dent Traumatol 1999; 15: 127-31.
Popescu IG, Popescu M, Man D, et al. Drug allergy: incidence in terms
of age and some drug allergens. Med Interne 1984; 22: 195-202.
Portenier I, Haapasalo H, Rye A, Waltimo T, Ørstavik D, Haapasalo M.
Inactivation of root canal medicaments by dentine, hydroxylapatite and
bovine serum albumin. Int Endod J 2001; 34: 184-8.
Portenier I, Waltimo T, Haapasalo M. Enterococcus faecalis—the root
canal survivor and “star” in post-treatment disease. Endod Topics 2003;
6: 135-60.
Ram Z. Effectiveness of root canal irrigation. Oral Surg Oral Med Oral
Pathol 1977; 44 :306-12.
Reit and G. Dáhlen, Decision making analysis of endodontic treatment
strategies in teeth with apical periodontitis, Int Endod J 1988; 21;
291-9.
Reynolds
MA, Madison S, Walton RE, Krell KV,. Rittman BRJ. An in vitro
histological comparison of the step-back, sonic, and ultrasonic
instrumentation techniques in small, curved root canals. J Endod 1987;
13: 307–14.
Ringel AM, Patterson SS, Newton CW, Miller CH, Mulhern JM. In vivo
evaluation of chlorexidine gluconate solution and sodium hypochlorite
solution as root canal irrigants J Endod 1982; 8: 200-4.
Ringel AM, Patterson SS, Newton CW, Miller CH, Mulhern JM. In vivo
evaluation of chlorhexidine gluconate solution and sodium hypochlorite
solution as root canal irrigants. J Endod 1982; 8: 200-4.
Rölla G, Loe H, Schiott CR. Retention of chlorhexidine in the human
oral cavity. Arch Oral Biol 1971; 16: 1109-16.
Rölla G, Loe H, Schiott CR. The affinity of chlorhexidine for
hydroxyapatite and salivary mucins. J Periodontal Res 1970; 5: 90-5.
Roy RA, Ahmad M, Crum LA. Physical mechanisms governing the
hydrodynamic response of an oscillating ultrasonic file. Int Endod J
1994; 27: 197-207.
Russell RG, Rogers MJ. Bisphosphonates: from the laboratory to the
clinic and back again. Bone 1999; 25: 97-106.
Safavi KE, Spangberg LSW, Langeland K. Root canal dentinal tubule
disinfection. J Endod 1990; 16: 207-10.
Saleh
IM, Ruyter IE, Haapasalo M, Ørstavik D. Survival of Enterococcus
faecalis ininfected dentinal tubules after root canal filling with
different root canal sealers in vitro. Int Endod J 2004; 37: 193-8.
Sarbinoff JA, O’Leary TJ, Miller CH. The comparative effectiveness of
various agents in detoxifying diseased root surfaces. J Periodontol
1983; 54: 77-80.
Schilder H. Cleaning and shaping the root canal. Dent Clin North Am
1974;18: 269-96.
Schilder H. Cleaning and shaping the root canal. Dent Clin North Am
1974; 18: 269-96.
Seal GJ, Ng YL, Spratt D, Bhatti M, Gulabivala K. An in vitro
comparison of the bactericidal efficacy of lethal photosensitization or
sodium hyphochlorite irrigation on Streptococcus intermedius biofilms
in root canals. Int Endod J 2002; 35: 268-74.
Seltzer S, Bender IB, Turkenkopf S. Factors affecting successful repair
after root canal therapy. J Am Dent Assoc.1963; 67: 651-62.
Seltzer S, Bender IB, Ziontz M. The dynamics of pulp inflammation:
correlation between diagnostic data and actual histologic findings in
the pulp. Oral Surg Oral Med Oral Pathol 1963; 16: 846-71.
Seltzer S. Endodontology. Biologic Considerations in Endodontic
Procedures, 2nd edn. Philadelphia, USA: Lea & Febiger, 1988.
Sen
BH, Safavi KE, Spångberg LS. Antifungal effects of sodium hypochlorite
and chlorhexidine in root canals. J Endod 1999; 25: 2358.
Senia ES, Marshall FJ, Rosen S. The solvent action of sodium
hypochlorite on pulp tissue of extracted teeth. Oral Surg Oral Med Oral
Pathol 1971; 31: 96-103.
Senia ES, Marshall FJ, Rosen S. The solvent action of sodium
hypochlorite on pulp tissue of extracted teeth. Oral Surg Oral Med Oral
Pathol 1971; 31: 96-103.
Shih M, Marshall F, Rosen S. The bactericidal efficiency of sodium
hypochlorite as an endodontic irrigant. Oral Surg Oral Med Oral Pathol
1970; 29: 613-9.
Shiozawa A. Characterization of reactive oxygen species generated from
the mixture of NaClO and H2O2 used as root canal irrigants. J Endod
2000; 26:11-15.
Shipper G, Ørstavik D, Teixeira FB, Trope M. An evaluation of microbial
leakage in roots filled with a thermoplastic synthetic polymer-based
root canal filling material (Resilon). J Endod 2004; 30: 342-7.
Shovelton DS. The presence and distribution of microorganisms with
nonvital teeth. Br Dent J 1964; 117: 101-7.
Silva LA, Leonardo MR, Assed S, Tanomaru Filho M. Histological study of
the effect of some irrigating solutions on bacterial endotoxin in dogs.
Braz Dent J 2004; 15: 109-14.
Sim TP, Knowles JC, Ng YL, Shelton J, Gulabivala K. Effect of sodium
hypochlorite on mechanical properties of dentine and tooth surface
strain. Int Endod J 2001; 34: 120-32.
Siqueira JF Jr, Rôças IN, Santos SRLD, Lima KC, Magalhães FAC, and De
Uzeda M. Efficacy of instrumentation techniques and irrigation regimens
in reducing the bacterial population within root canals. J Endod 2002;
28: 181-4.
Siqueira JF Jr, Gonçalves RB. Antibacterial activities of root canal
sealers against selected anaerobic bacteria. J Endod 1996; 22: 89-90.
Siqueira Jr JF, Lopes HP, Uzeda M. Atividade antibacteriana de
medicamentos endodônticos sobre bactérias anaeróbias estritas. Rev
Assoc Paul Cir Dent 1996; 50: 326-32.
Siqueira Jf Jr, Magalhães FAC, Uzeda M. Avaliação da atividade
antibacteriana de medicação intracanal. Très bases fortes e pastas à
base de hidróxido de cálcio e paramonoclorofenol canforado. RGO 1996;
44: 271-4.
Siqueira Jr JF, Uzeda M. Disinfection by calcium hydroxide pastes of
dentinal tubules infected with two obligate and one facultative
anaerobic bacteria. J Endod 1996; 22: 674-6.
Siqueira JF Jr, Uzeda M, Fonseca MEL. Scanning electron microscopic
evaluation of in vitro dentinal tubules penetration by selected
anaerobic bacteria. J Endod 1996; 22: 308-10.
Siqueira JF Jr Tratamento das Infecc,oÄes EndodoÃnticas. Rio de
Janeiro, Brazil: Medsi, 1997.
Siqueira Jr JF, Lopes HP, Magalhães FAC, Uzeda. M. Atividade
antibacteriana da pasta de hidróxido de cálcio/paramonoclorofenol c
nforado/glicerina contendo diferentes proporções de iodofórmio sobre
bactérias anaeróbias estritas e facultativas. Rev Paul Odontol 1997;
19: 17-21.
Siqueira JF Jr, Machado AG, Silveira RM, Lopes HP, Uzeda M. Evaluation
of the effectiveness of sodium hypochlorite used with three irrigation
methods in the elimination of Enterococcus faecalis from the root
canal. Int Endod J 1997; 30: 279-83.
Siqueira JF Jr, Uzeda M. Intracanal medicaments: evaluation of the
antibacterial effects of chlorhexidine, metronidazole, and calcium
hydroxide associated with three vehicles. J Endod 1997; 23: 167-9.
Siqueira Jr JF, Lopes HP, Uzeda M. Recontamination of coronally
unsealed root canals medicated with camphorated paramonochlorophenol or
calcium hydroxide pastes after saliva challenge. J Endod 1998; 24: 11-4.
Siqueira JF Jr, Uzeda M . Influence of different vehicles on the
antibacterial effects of calcium hydroxide. J Endod 1998; 24; 663-5.
Siqueira Jr JF, Lopes HP. Mechanisms of antimicrobial activity of
calcium hydroxide: a critical review. Int Endod J 1999; 32: 361-9.
Siqueira JF, Jr., Rjcas IN, Souto R, de Uzeda M, Colombo AP.
Actinomyces species, streptococci, and Enterococcus faecalis in primary
root canal infections. J Endod 2002; 28: 168 -72.
Siren EK, Haapasalo MPP, Ranta K, Salmi P, Kerosuo ENJ. Microbiological
findings and clinical procedures in endodontic cases selected for
microbiological investigation. Int Endod J 1997; 30: 91-5.
Sirtes
G, Waltimo T, Schaetzle M, Zehnder M. The effects of temperature on
sodium hypochlorite short-term stability, pulp dissolution capacity,
and antimicrobial efficacy. J Endod 2005; 31: 669-71.
Sjögren U, Sundqvist G. Bacteriologic evaluation of ultrasonic root
canal instrumentation.Oral Surg Oral Med Oral Pathol 1987; 63: 366-70.
Sjögren
U, Figdor D, Spångberg L, Sundqvist G. The antimicrobial effect of
calcium hydroxide as a short-term intracanal dressing. Int Endod J
1991; 24; 119-25.
Sjögren U. Success and failure in endodontics (Odontological
Dissertation No. 60). Umea, Sweden: Umea University 1996.
Sjögren U, Figdor D, Persson S, Sundqvist G. Influence of infection at
the time of root filling on the outcome of endodontic treatment of
teeth with apical periodontitis. Int Endod J 1997; 30: 297-306.
Smith RM, Martell AE. Critical stability constants. New York: Plenum
Press, 1976.
Solovyeva AM, Dummer PM. Cleaning effectiveness of root canal
irrigation with electrochemically activated anolyte and catholyte
solutions: a pilot study. Int Endod J 2000; 33: 494-504.
Spångberg L, Engström B, Langeland K. Biologic effects of dental
materials. 3. Toxicity and antimicrobial effect of endodontic
antiseptics in vitro. Oral Surg Oral Med Oral Pathol 1973; 36: 856-71.
Spångberg L, Kaufman A, Spångberg E, Rutberg M. Salvizol as an
intracanal antiseptic for endodontic use. Oral Surg Oral Med Oral
Pathol 1978; 46: 427-32.
Spångberg L, Rutberg M, Rydinge E. Biologic effects of endodontic
antimicrobial agents. J Endod 1979; 5: 166-75.
SpångbergL, Engström B, Langeland K. Biologic effects of dental
materials. 3. Toxicity and antimicrobial effect of endodontic
antiseptics in vitro. Oral Surg Oral Med Oral Pathol 1973; 36: 856-71.
SpångbergL. Kinetic and quantitative evaluation of material
cytotoxicity in vitro. Oral Surg Oral Med Oral Pathol 1973; 35: 389-401.
Spratt DA, Pratten J, Wilson M, Gulabivala K. An in vitro evaluation of
the antimicrobial efficacy of irrigants on biofilms of root canal
isolates. Int Endod J 2001; 34: 300-7.
Stevens RH, Grossman LI. Evaluation of the antimicrobial potential of
calcium hydroxide as an intracanal medicament. J Endod 1983; 9: 372-4.
Stewart
GG. A study of a new medicament in the chemomechanical preparation of
infected root canals. J Am Dent Assoc 1961; 63: 33-7.
Stewart GG, Kapsimalas P, Rappaport H. EDTA and urea peroxide for root
canal preparation. J Am Dent Assoc 1969; 78: 335- 8.
Stock CJ. Current status of the use of ultrasound in endodontics. Int
Dent J 1991; 41: 175-82.
Stuart KG, Miller CH, Brown CE Jr, Newton CW. The comparative
antimicrobial effect of calcium hydroxide. Oral Surg Oral Med Oral
Pathol 1991; 72: 101-4.
Sundqvist
G. Bacteriological studies of necrotic dental pulps. Umeå: Umeå
University, 1976.
Sundqvist G. Taxonomy, ecology, and pathogenicity of the root canal
flora. Oral Surg Oral Med Oral Pathol 1994; 78: 522-30.
Sundqvist G, Figdor D, Persson S, Sjogren U. Microbiologic analysis of
teeth with failed endodontic treatment and the outcome of conservative
re-treatment. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998;
85: 86-93.
Svec
AT, Harrison JW. The effect of effervescence on debridement of the
apical regions of root canals in single-rooted teeth. J Endod 1981; 7:
335-40
Svec TA, Harrison JW. Chemomechanical removal of pulpal and dentinal
debris ... and hydrogen peroxide vs normal saline solution. J Endod
1977; 3: 49-53.
Tanomaru JM, Leonardo MR, Tanomaru Filho M, Bonetti Filho I, Silva LA.
Effect of different irrigation solutions and calcium hydroxide on
bacterial LPS. Int Endod J 2003; 36: 733-9.
Tasman F, Cehreli ZC, Ogan C, Etikan I. Surface tension of root canal
irrigants. J Endod 2000; 26: 586-7.
Taylor HD & Austin JH. The solvent action of anti- septics on
necrotic tissue. J Exp Med. 1918; 27: 155-164.
Test ST, Lampert MB, Ossanna PJ, Thoene JG, Weiss SJ. Generation of
nitrogenchlorine oxidants by human phagocytes. J Clin Invest 1984; 74:
1341-9.
Teuscher GW, Zander HA. A preliminary report on pulpotomy, Northwestern
University Bulletin 1938; 39: 4-13.
Thé
SD. The solvent action of sodium hypochlorite on fixed and unfixed
necrotic tissue. Oral Surg Oral Med Oral Pathol 1979; 47:558-61.
Thé SD. The solvent action of sodium hypochlorite on fixed and unfixed
necrotic tissue. Oral Surg Oral Med Oral Pathol 1979; 47: 558-61.
Torabinejad M, Khademi AA, Babagoli J, et al. A new solution for the
removal of the smear layer. J Endod 2003; 29: 170 -5.
Torneck CD, Smith JS, Grindall P. Biologic effects of endodontic
procedures on developing incisor teeth. IV. Effect of debridement
procedures and calcium hydroxidecamphorated parachlorophenol paste in
the treatment of experimentally induced pulp and periapical disease.
Oral Surg Oral Med Oral Pathol 1973; 35; 541-54.
Trepagnier
CM, Madden RM, Lazzari EP. Quantitative study of sodium hypechlorite as
an in vitro endodontic irrigant. J Endod 1977; 3: 194-6.
Tronstad
L, Andreasen JO, Hasselgren G, Kristerson L, Riis I. pH changes in
dental tissues after root canal filling with calcium hydroxide. J Endod
1981; 7: 17-21.
Tronstad L. Root resorption etiology, terminology and clinical
manifestations. Endod Dent Traumatol 1988; 4; 241-52.
Tronstad L Recent development in endodontic research. Scand J Dent Res
1992; 100: 52-9.
Vahdaty A, Pitt Ford TR, Wilson RF. Efficacy of chlorhexidine in
disinfecting dentinal tubules in vitro. Endod Dent Traumatol 1993; 9:
243-8.
Van der Sluis LW, Wu MK, Wesselink PR. A comparison between a smooth
wire and a K-file in removing artificially placed dentine debris from
root canals in resin blocks during ultrasonic irrigation. Int Endod J
2005; 38: 593-6.
Van der Sluis LW, Wu MK, Wesselink PR. The efficacy of ultrasonic
irrigation to remove artificially placed dentine debris from human root
canals prepared using instruments of varying taper. Int Endod J 2005;
38: 764-8.
Van Klingeren B, Pullen W, Reijnders HF. Quantitative suspension test
for the evaluation of disinfectants for swimming pool water:
experiences with sodium hypochlorite and sodium dichloroisocyanurate.
Zentralbl Bakteriol [B] 1980; 170: 457-68.
Voet D, Voet JG. Biochemistry, 2nd edn. New York, USA: John Wiley &
Sons, Inc., 1995.
Vojinovic
O, Nyborg H, Brännström M. Acid treatment of cavities under resin
fillings: bacterial growth in dentinal tubules and pulpal reactions. J
Dent Res 1973: 52: 1189-93.
Walker A. A definite and dependable therapy for pulpless teeth. J Am
Dent Assoc 1936; 23: 1418 –25.
Walmsley AD. Ultrasound and root canal treatment: the need for
scientific evaluation. Int Endod J 1987; 20: 105-11.
Waltimo TM, Sirén EK, Torkko HL, Olsen I, Haapasalo MP. Fungi in
therapy-resistant apical periodontitis. Int Endod J 1997; 30: 96-101.
Wang JD, Hume WR. Diffusion of hydrogen ion and hydroxyl ion from
various sources though dentine. Int Endod J 1988; 21: 17-26.
Weine
FS, Kelly RF, Lio PJ. The effect of preparation procedures on original
canal shape and on apical foramen shape. J Endod 1975; 1: 255-62..
Weine FS, Smulson MH. A microbiologic evaluation of endodontic
instrumentation in pulpless teeth. Oral Surg Oral Med Oral Pathol 1973;
35: 676-83.
White RR, Goldman M, Lin PS. The influence of the smear-layer upon
dentinal tubule penetration by plastic filling materials. J Endod 1984;
10: 558-62.
Wilson M. Susceptibility of oral bacterial biofilms to antimicrobial
agents. J Med Microbiol 1996; 44: 7987.
Yamada RS, Armas A, Goldman M, Lin PS. A scanning electron microscopic
comparison of high volume final flush with several irrigating
solutions. Part 3. J Endodon 1983; 9: 137-42.Abbott PV, Heijkoop PS,
Cardaci SC, Hume WR, Heithersay GS. An SEM study of the effects of
different irrigation sequences and ultrasonics. Int Endod J 1991; 24:
308-16.
Yamada RS, Armas A, Goldman M, Lin PS. A scanning electron microscopic
comparison of a high volume final flush with several irrigating
solutions: part 3. J Endod 1983; 9: 137-42.
Yguel-Henry S, Vannesson H, von Stebut J. High precision, simulated
cutting efficiency measurement of endodontic root canal instruments:
influence of file configuration and lubrication. J Endod 1990; 16:
418-22.
Yoshida T, Shibata T, Shinohara T, Gomyo S, Sekine I. Clinical
evaluation of the efficacy of EDTA solution as an endodontic irrigant.
J Endod 1995; 21: 592-3.
Zamany A, Safavi K, Spångberg LS. The effect of chlorhexidine as an
endodontic disinfectant. Oral Surg Oral Med Oral Pathol Oral Radiol
Endod 2003; 96: 578-81.
Zambon JJ, Haraszthy VI. The laboratory diagnosis of periodontal
infections. Periodontol 2000 1995: 7: 69-82.
Zander
HA. Reaction of the dental pulp to calcium hydroxide. J Dent Res 1939;
18: 373-9.
Zehnder
M, Gold SI, Hasselgren G. Pathologic interactions in pulpal and
periodontal tissues. J Clin Periodontol 2002; 29: 663-71.
Zehnder M, Grawehr M, Hasselgren G, Waltimo T. Tissue-dissolution
capacity and dentin-disinfecting potential of calcium hydroxide mixed
with irrigating solutions. Oral Surg Oral Med Oral Pathol Oral Radiol
Endod 2003; 96: 608-13.
Zehnder M, Kosicki D, Luder H, Sener B, Waltimo T. Tissue-dissolving
capacity and antibacterial effect of buffered and unbuffered
hypochlorite solutions. Oral Surg Oral Med Oral Pathol Oral Radiol
Endod 2002; 94: 756-62.
Zehnder M, Schicht O, Sener B, Schmidlin P. Reducing surface tension in
endodontic chelator solutions has no effect on their ability to remove
calcium from instrumented root canals. J Endod 2005; 31: 590-2.
Zehnder M, Schmidlin P, Sener B, Waltimo T. Chelation in root canal
therapy reconsidered. J Endod 2005; 31 :817-20.
Zehnder M, Söderling E, Salonen J, Waltimo T. Preliminary evaluation of
bioactive glass S53P4 as an endodontic medication in vitro. J Endod
2004; 30: 220-4.
Zehnder M. Root canal irrigants. J Endod 2006; 32: 389-98.
|